题目内容
已知:H2(g) +I2(g)  2HI(g) ΔH =" -14.9" kJ/mol。在甲、乙两个体积相同密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)="0.008" mol/L。 下列判断正确的
2HI(g) ΔH =" -14.9" kJ/mol。在甲、乙两个体积相同密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。甲中反应达到平衡时,测得c(H2)="0.008" mol/L。 下列判断正确的
| 起始浓度 | c(H2) / mol/L | c(I2) / mol/L | c(HI) / mol/L |
| 甲 | 0.01 | 0.01 | 0 |
| 乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25
D
解析试题分析:A、该反应前后气体的体积不变,乙中的浓度为甲中的2倍,乙中压强为甲中2倍,压强不影响平衡移动,二者为等效平衡,平衡时对应各组分的转化率相同,错误;B、二者为等效平衡,平衡时乙中c(I2)是甲中的2倍,平衡时乙中颜色更深,错误;C、二者为等效平衡,反应物转化率相同,乙中参加反应I2的是甲中的2倍,乙中的热量变化是甲中的2倍,错误;D、平衡时氢气的浓度为0.008mol/L,则:
H2(g)+I2(g)?2HI(g)△
开始(mol/L):0.01 0.01 0
变化(mol/L):0.002 0.002 0.004
平衡(mol/L):0.008 0.008 0.004
故该温度下该反应的平衡常数k=0.0042×(0.008×0.008)=0.25,正确。
考点:本题考查等效平衡、化学平衡常数的计算、影响化学平衡的因素。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
| A.0~t2时,v正>v逆 |
| B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ |
| C.t2时刻改变的条件可以是向密闭容器中加C |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
在一定温度下,向容积固定且不变的某密闭容器中充入a mol NO2,发生如下反应:
2NO2(g)  N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);ΔH < 0。达平衡后再向容器中充入a mol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: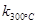 >
>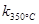 ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么 a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
对于可逆反应H2(g) + I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A.H2(g)的消耗速率与HI(g)的生成速率比为2:1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率不一定相等 |
已知:2M(g) N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )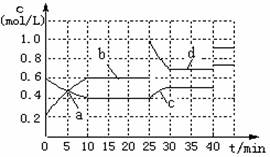
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D.若40min后出现如图所示变化,则可能是加入了某种催化剂 |
 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化如图示曲线。下列说法正确的是
 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是