题目内容
已知反应:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
在427°C时的平衡常数是9.4.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol·L-1,计算一氧化碳在此反应条件下的转化率。
75.4﹪
解析试题分析:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始:0.01mol/L 0.01mol/L 0 0
转化: x x x x
平衡0.01-x 0.01-x x x
依题意有: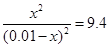 解之得:x=0.754mol
解之得:x=0.754mol
因此一氧化碳在此反应条件下的转化率为: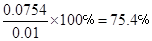
考点:考查平衡常数与转化率。

 阅读快车系列答案
阅读快车系列答案甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
②2CO(g)+O2(g) =2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) △H= 。
CH3OH(g) △H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。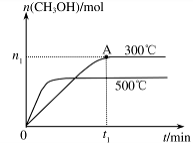
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
(4)CH4和H2O在催化剂表面发生反应CH4+H2O
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀 (填“能”或“否”)。
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
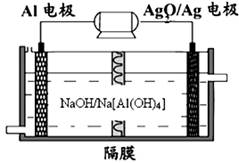
请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。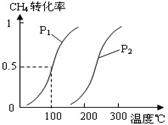
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
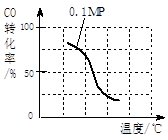
I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,c2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g)
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。 (10分)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
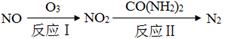
 SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1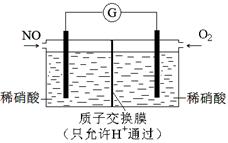
 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求: