题目内容
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
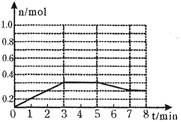
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。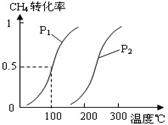
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
a.请在上表空格中填入剩余的实验条件数据。
b.根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
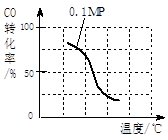
(共16分)
(1)(7分)①0.003mol/(L·min)(2分) ②<(2分) 2.25×10-4(3分)
(2)(9分)③<(2分) BD(2分)
④a.(见下表,3分) 实验编号 T(℃) n(CO)/n(H2) P(Mpa) i ii 150 1/3 iii 1/3
b.(见下图,2分)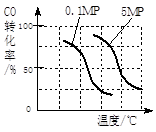
解析试题分析:(1)①起始时c(CH4)=1.0mol/100L=0.01mol/L,读图可知平衡时CH4转化率为0.5,则CH4的变化浓度为0.01mol/L×0.5=0.005mol/L,根据化学反应速率计算公式可知,v(CH4)= 0.005mol/L÷5min=0.001mol/(L?min),根据系数之比等于速率之比可知,v(H2)="3" v(CH4)= 0.003mol/(L?min);②I是气态物质体积增大的反应,因此增大压强平衡左移,CH4转化率减小,减小压强平衡右移,CH4转化率增大,即压强越小,CH4转化率越大,读图可知,200℃、P1时CH4转化率大于200℃、P2时CH4转化率,说明P1< P2;在P1、100℃时,
CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度/ mol·L-1 0.01 0.02 0 0
变化浓度/ mol·L-1 0.005 0.005 0.005 0.015
平衡浓度/ mol·L-1 0.005 0.015 0.005 0.015
K="[" c(CO)?c3(H2)]/[ c(CH4)?c(H2O)]= [0.005×0.0153]/[ 0.005×0.015]=2.25×10ˉ4
(2)③II是气态物质体积减小的反应,不符合熵增原理,则正反应符合焓判据,△H<0;正反应是放热反应,升高温度平衡左移,甲醇产率减小,故A错误;减小生成物浓度,平衡右移,甲醇产率增大,故B正确;充入惰性气体,虽然增大压强,但是容器容积不变,各组分浓度不变,平衡不移动,甲醇产率不变,故C错误;再充入投料比相同的CO和H2,就是增大压强,使平衡右移,甲醇产率增大,故D正确;④a、根据控制变量探究的原则,实验i和ii的压强不同,则温度和投料比一定相同;实验ii和iii的温度不同,则投料比和压强一定相同;由此确定实验ii的温度为150℃,投料比为1/3,实验iii的投料比为1/3;b、画图要点:相同温度下,增大压强平衡右移,CO转化率增大,则0.1MPa时CO转化率随温度变化曲线向右适当平移,就变为5MPa时CO转化率随温度变化曲线。
考点:考查化学反应原理,涉及化学反应速率的计算、压强对化学平衡的影响、化学平衡常数的计算、反应热的正负、提高产率的措施、探究实验方案的设计、画图等常见考查方式。

硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01×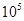 Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2, (g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g) △H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示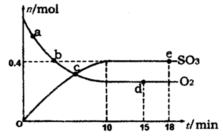 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
| A.a点时刻的正反应速率比b点时刻的大 |
| B.c点时刻反应达到平衡状态 |
| C.d点和e点时刻的c(O2)相同 |
| D.若5 00℃,1.01×105Pa下,反应达到平衡时,n( SO3) 比图中e点时刻的值大 |
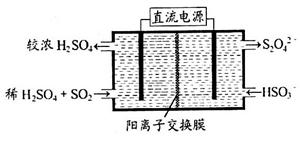
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
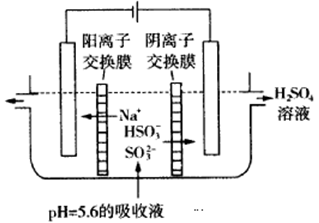
HSO3-在阳极室反应的电极反应式为________________________,阴极室的产物_________________。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1则CO(g)+H2O(g)
 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H= (3)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2(g)
 CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。若用该电池提供的电能电解60mL NaCl溶液,设有0.01molCH3OH完全放电,NaCl足量,且电解产生的Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字) 。
改变反应的某一条件,反应进行到tmin时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。不同实验条件下反应,N2浓度随时间变化如下图1。
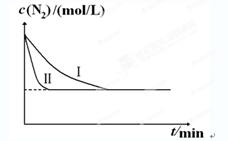

图1 图2
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为 。
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在上图2中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有:__________、__________等。
(2)若用如图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为________、________等。
(3)此反应以浓硫酸为催化剂,可能会造成__________、__________等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%)* | | 反应时间/h | 转化率(%) | 选择性(%)* |
| 40 | 77.8 | 100 | | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | | 6 | 93.0 | 100 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为________。
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
反应速率最大的(填0~1、1~2、2~3、3~4、4~5min)时间段为 。原因是 。
②反应速率最小的时间段为 ,原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率。
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是 (填相应字母);做法不可行的是 (填相应字母),做法不可行的理由是 。
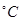 时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g)
时,在2L的恒容密闭容器中充入2molNO和1molO2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。
2NO2(g),经5min达到平衡,测得c(NO)="0.5" mol/L,并放热QkJ。5min内 v(O2)=___________。 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。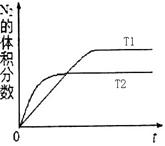
 H2(g)+CO2(g)
H2(g)+CO2(g) E(g)
E(g)