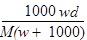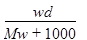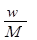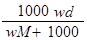题目内容
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )

A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL

A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
D
试题分析:观察图象,B曲线不产生气体需要盐酸的体积少于产生气体需要盐酸的体积,B曲线为Na2CO3和NaHCO3混合溶液,A曲线不产生气体需要盐酸的体积多于产生气体需要盐酸的体积,A曲线为Na2CO3和NaOH混合溶液。B错误。
B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为:H++CO32-=HCO3-,C错误;
无论A曲线或B曲线,当加入盐酸75mL时,产生二氧化碳气体体积最大,此时恰好完全反应,溶液中溶质为NaCl,Na+来自氢氧化钠,Cl-来自盐酸,n(Na+)=n(Cl-)=n(NaOH)=0.0075mol,所以每份溶液中c(NaOH)=0.75mol/L,A错误;
设B曲线溶液中Na2CO3物质的量为xmol,NaHCO3物质的量为ymol,
0→25发生反应:CO32-+H+=HCO3-
x x x
25→75发生反应:HCO3-+H+=H2O+CO2↑
x+y x+y
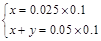
n(CO2)=x+y=0.005mol,V(CO2)=112mL,D正确。
点评:氢氧化钠溶液中通入二氧化碳气体,按二氧化碳由少到多,所得溶液中溶质可能为:(1)NaOH+Na2CO3;(2)Na2CO3;(3)Na2CO3+NaHCO3;(4)NaHCO3。

练习册系列答案
相关题目