题目内容
4.将2mol SO2和1mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3 (g).若经过2s后测得SO3的浓度为0.6mol/L.试计算:(1)O2的化学反应速率V(O2)=0.15mol/(L.s);
(2)2s时的O2浓度0.7mol/L.
分析 若经过2s后测得SO3的浓度为0.6mol/L,物质的量=0.6mol/L×1L=0.6mol,利用三段式计算各组分的浓度变化量、2s时各组分的浓度,根据v=$\frac{△c}{△t}$计算v(O2),根据c=$\frac{n}{V}$计算浓度.
解答 解:(1)若经过2s后测得SO3的浓度为0.6mol/L,物质的量=0.6mol/L×1L=0.6mol;
2SO2(g)+O2(g)?2SO3 (g)
起始量(mol) 2 1 0
变化量(mol) 0.6 0.3 0.6
2s量(mol) 1.4 0.7 0.6
O2的化学反应速率V(O2)=$\frac{\frac{0.3mol}{1L}}{2s}$=0.15mol/(L.s),故答案为:0.15mol/(L.s);
(2)2s时的O2浓度=$\frac{0.7mol}{1L}$=0.7mol/L,故答案为:0.7mol/L.
点评 本题主要是反应速率的计算,掌握基础是关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列各对原子序数的原子能以共价键结合成化合物的是( )
| A. | 6和17 | B. | 9和11 | C. | 1和11 | D. | 12和17 |
10.下列离子方程式书写正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 将标准状况下112mL氯气通入10mL 1mol•L-1的溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3+CO32-+2H2O |
9.下列分子中的所有原子都满足最外层8电子结构的是( )
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 氮气 (N2) |
16.清明假期期间各地对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图 ,下列关于该物质的说法正确的是( )
,下列关于该物质的说法正确的是( )
 ,下列关于该物质的说法正确的是( )
,下列关于该物质的说法正确的是( )| A. | 其分子式为C15H21O4 | |
| B. | 分子中只含有两种极性共价键 | |
| C. | 既能发生加聚反应,又能发生酯化反应 | |
| D. | 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
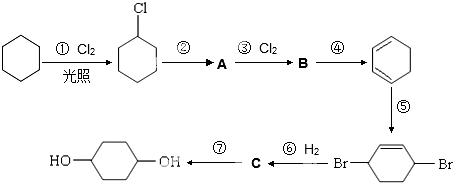
 ;
;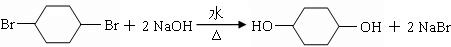 .
.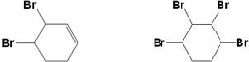 .
.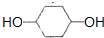 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$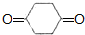 +2H2O.
+2H2O.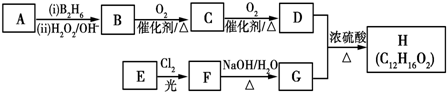
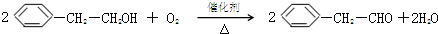 .
. .
.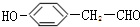 .
.
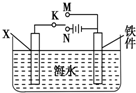 对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.