题目内容
9.下列各对原子序数的原子能以共价键结合成化合物的是( )| A. | 6和17 | B. | 9和11 | C. | 1和11 | D. | 12和17 |
分析 共价键是非金属元素原子之间通过公用电子对形成的化学键,形成共价键的条件是非金属元素原子之间;离子键是阴阳离子通过得失电子形成的化学键,形成离子键的条件是阴、阳离子,对于元素周期表中第一、第二主族中活泼的金属元素与第六、第七主族中活泼的非金属元素之间.
解答 解:A.6和17分别是C和Cl,形成的是共价键,故A正确;
B.9和11分别是F和Na,形成的是离子键,故B错误;
C.1和11分别是氢和钠,形成的是离子键,故C错误;
D.12和17分别是Mg和Cl,形成的是离子键,故D错误;
故选A.
点评 本题考查了化学键的判断以及含氢键的物质,难度不大,注意金属和非金属元素之间可能形成共价键,如氯化铝中只存在共价键,不含离子键.

练习册系列答案
相关题目
3.下列关于石墨的性质和用途的说法不正确的是( )
| A. | 熔点高,有滑腻感,可用于制润滑剂 | |
| B. | 质软,在纸上划过留痕迹,可用于制铅笔芯 | |
| C. | 有良好的导电性,可用于制干电池的电极 | |
| D. | 耐高温,可用于制作刻划玻璃的工具 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| B. | 标准状况下,2.24L乙酸中含有分子的数目为0.1NA | |
| C. | 1L 1mol•L-1的FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 标准状况下,2.24 L C12与足量稀NaOH反应转移电子数为0.2NA |
4.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| B. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| C. | 标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA | |
| D. | 20 g重水(D2O)中含有的电子数为10NA |
14.“绿色化学”追求减少化工生产对环境造成的污染,下列物质可称为“绿色氧化剂”的是( )
| A. | 浓硫酸 | B. | “84”消毒液 | C. | 漂白粉 | D. | 双氧水 |
18.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4 NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
 钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价.根据图示晶胞结构,推算晶体中Y、Ba、Cu和O原子个数比,确定其化学式为YBa2Cu3O7.
钇钡铜氧的晶胞结构如图.研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价.根据图示晶胞结构,推算晶体中Y、Ba、Cu和O原子个数比,确定其化学式为YBa2Cu3O7.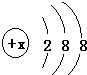 有几种元素的微粒的电子层结构如图所示,其中:
有几种元素的微粒的电子层结构如图所示,其中: