题目内容
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式___。
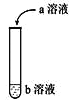
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ||
稀盐酸 | Na2CO3 |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:___。
NaIO3+NaHSO3=I2+Na2SO4+H2SO4+H2O
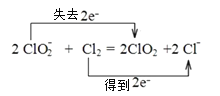
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目___。
【答案】
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | 立刻产生气泡 | CO32-+2H+=H2O+CO2↑ |
稀盐酸 | Na2CO3 | 开始时无气泡,后来有气泡 | CO32-+H+= HCO3-; HCO3-+H+=H2O+CO2↑ |
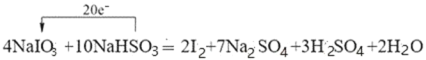
【解析】
(1)将碳酸钠逐滴加入到盐酸溶液中,盐酸过量,加入后碳酸钠立刻转化为二氧化碳,迅速产生气体;将盐酸逐滴加入碳酸钠溶液中,盐酸少量,碳酸钠转化为碳酸氢钠,开始无气体,随着盐酸加入的量增加,碳酸氢钠转化为二氧化碳、水和氯化钠,产生气体;
(2)NaIO3和NaHSO3反应来制取单质I2,碘元素由+5价变为0价,硫元素由+4价变为+6价,根据得失电子守恒,反应中转移20e-,据此配平化学方程式并用单线桥法表示电子转移的方向和数目;
(3)工业上可用Cl2氧化NaClO2溶液制取ClO2,氯气被还原为氯离子,ClO2-被氧化为ClO2,反应中转移电子数目为2e-,根据氧化还原反应中化合价升降相等书写离子反应方程式。
(1)将碳酸钠溶液滴入到稀盐酸中,盐酸过量,开始就产生气泡,其离子反应方程式为:CO32-+2H+=H2O+CO2↑;将稀盐酸滴入到碳酸钠溶液中,盐酸少量,开始时无气泡,后来产生气泡,其离子反应方程式为:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑;
(2) NaIO3溶液中滴加少量NaHSO3溶液时,HSO3-被氧化成SO42,IO3-被还原成I2,根据电子守恒和元素守恒,该反应为:4NaIO3+10NaHSO3═2I2+7Na2SO4+3H2SO4+2H2O,该反应中转移的电子数为20e-,用单线桥法表示电子转移的方向和数目为: 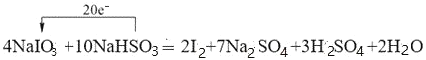 ;
;
(3)Cl2氧化NaClO2溶液制取ClO2,氯气本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子反应方程式为:2ClO2-+Cl2=2ClO2+2Cl-;双线桥法表示电子转移的方向和数目为: 。
。