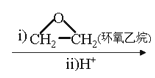
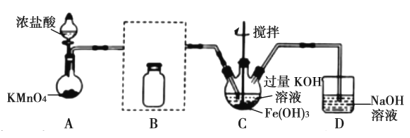
题目内容
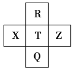
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
【答案】A
【解析】
A.碳酸氢钠溶液水解显碱性,结合氯化铁水解生成的氢离子,促进了氯化铁的水解,故A正确;
B.溶液中FeCl3的水解反应离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+,可见Cl-不参加水解反应,加入硝酸银,Ag+和Cl-结合生成氯化银沉淀,不影响氯化铁的水解,故B错误;
Fe(OH)3+3H+,可见Cl-不参加水解反应,加入硝酸银,Ag+和Cl-结合生成氯化银沉淀,不影响氯化铁的水解,故B错误;
C.加入氯化铁固体,增加Fe3+的浓度,水解平衡正向移动,但氯化铁的水解程度减小,故C错误;
D.水解反应是吸热反应,温度降低,水解平衡逆向移动,即抑制水解,故D错误;
故答案为A。

练习册系列答案
相关题目
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式___。
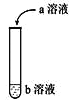
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ||
稀盐酸 | Na2CO3 |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:___。
NaIO3+NaHSO3=I2+Na2SO4+H2SO4+H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目___。