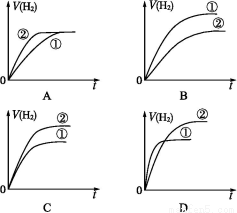
题目内容
测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 g·mL-1。
(1)2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
(2)当滴入1滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色
(3)1.0×10-4
【解析】因为滴加酸性KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴酸性KMnO4溶液由无色变为浅紫色且半分钟不褪色的方法来判断终点。由题意知可能发生反应的离子方程式为:2Mn+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O、Ca2++C2
2Mn2++10CO2↑+8H2O、Ca2++C2 CaC2O4↓、CaC2O4+2H+
CaC2O4↓、CaC2O4+2H+ Ca2++H2C2O4。
Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+~5CaC2O4~5H2C2O4~2Mn
5 2
x 20.0×10-3 L×1.0×10-4 mol·L-1
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为=1.0×10-4 g·mL-1。

 阅读快车系列答案
阅读快车系列答案下表是几种常见弱酸的电离平衡常数(25 ℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10-5 |
H2CO3 | H2CO3 HCO3— | K1=4.4×10-7 K2=4.7×10-11 |
H2S | H2S HS- | K1=1.3×10-7 K2=7.1×10-15 |
H3PO4 | H3PO4 H2PO4— HPO42— | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
回答下列问题:
(1)当温度升高时,K值 (填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
。
(3)若把CH3COOH、H2CO3、HCO3—、H2S、HS-、H3PO4、H2PO4—、HPO42—都看成是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着一定的规律,此规律是 ,产生此规律的原因是 。