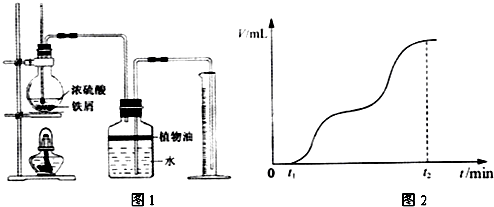
题目内容
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-现有16.8g铁和0.3molBr2反应后加入适量水后,通入amolCl2。
①.当a≤0.15时,反应离子方程式为
②.当Fe2+与Br-同时被氧化时,a的取值范围为
③.当a=0.3时,反应后氧化产物与还原产物的物质的量之比为 比
⑴2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ⑵ 0.15 < a ⑶9:4
(根据方程式6FeBr2+6Cl2=4FeCl3+2FeBr3+3Br2 得出9:4)
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目