题目内容
高铁酸钾(K2Fe04)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:
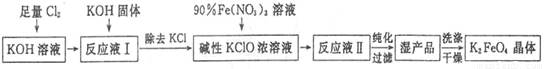
已知:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
回答下列问题:
(1)将Cl2通入KOH溶液中发生反应的离子方程式是____________。
(2)写出工业上制取Cl2的化学方程式____________。
(3)在“反应液I”中加入KOH固体的目的是____________。
(4)K2FeO4可作为新型多功能水处理剂的原因是____________。
(5)配制KOH溶液时,将61.6 g KOH固体溶解在100 mL水中,所得溶液的密度为 1.47 g • mL-1,则该溶液的物质的量浓度为____________。
(6)从“反应液II”中分离出K2Fe04后,副产品 是___________ (写 化 学 式)。
(7)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为______mol。
(1)Cl2+2OH- = Cl-+ ClO-+ H2O(2分)
(2)2NaCl + 2H2O 2NaOH
+ H2↑ + Cl2↑(2分)
2NaOH
+ H2↑ + Cl2↑(2分)
(3)与“反应液Ⅰ”中过量的Cl2继续反应生成KClO(2分)
(4)K2FeO4具有强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀。(2分)
(5)10 mol·L-1(3分)
(6)KNO3 KCl(2分)
(7)15 (2分)
【解析】
试题分析:注意刚开始通入足量的Cl2,多余的Cl2会干扰K2FeO4制备时的反应。由K2FeO4制备方程可知副产品为KNO3和KCl, (5)中根据物质的量浓度定义计算,n(KOH)=1.1mol,V=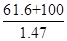 =109.9ml=0.11L可得C(KOH)=
10 mol·L-1,(7)根据氧化还原电子守恒,2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
=109.9ml=0.11L可得C(KOH)=
10 mol·L-1,(7)根据氧化还原电子守恒,2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O
Cl2+2KOH=KCl+KClO+H2O, 2K2Fe04~~3Cl2,
n(K2FeO4)=10mol,n(Cl2)=15mol
考点:本题化工工艺流程考察了方程式,物质性质,氧化还原,计算

|
高铁酸钾(K2Fe04)是一种新型、高效、多功能水处理剂,是比Cl2、O3,、C102.KMn04氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2Fe04)。湿法制备的主要反应方程式为:2Fe(OH)3+3C10一+40H________=2FeO42-+3Cl________+5H20,干法制备的主要反应方程式为:2FeS04+6Na202=2Na2Fe04+2Na20+2Na2S04+02下列有关说法不正确的是 | |
| [ ] | |
A. |
高铁酸钾中铁显+6价 |
B. |
湿法中每生成lmolNa2FeO4,转移3mol电子 |
C. |
干法中每6molNa202参加反应时电子转移的数目为12mol |
D. |
K2Fe04处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3,还能吸附水中的悬浮杂质 |
化学已经渗透到人类生活的各个方面,下列说法不正确的是( )
A.高铁酸钾(K2Fe04)是一种新型、高效、多功能水处 理剂,既能消毒杀菌又能净水。 理剂,既能消毒杀菌又能净水。 |
| B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 |
C.低碳生活注重节能减排,尽量使用 太阳能等代替化石燃料,减少温室气体的排放 太阳能等代替化石燃料,减少温室气体的排放 |
| D.高纯度的硅单质广泛用于制作光导纤维.光导纤维遇强碱会“断路” |