题目内容
【题目】四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
元素 | A | B | C | D |
性质 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx , 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 , B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为;
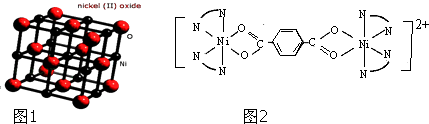
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不化简).
【答案】
(1)N>O>C
(2)sp2;直线型
(3)低;晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体
(4)先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液
(5)12;![]()
【解析】解:A原子核外有两个电子层,最外层有3个未成对的电子,原子核外电子排布式为1s22s22p3 , 则A为氮元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4 , 则B为硫元素;C原子核外电子排布为[Ar]3d104sx , 有+1、+2两种常见化合价,则C为Cu;D元素有种常见氧化物,其中有一种是冶金工业常用的还原剂,则D为C元素,(1)同周期随原子序数增大第一电离能呈增大趋势,N元素2p轨道容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能由大到下的顺序为N>O>C,所以答案是:N>O>C;(2)S元素的低价氧化物为SO2 , 分子中S原子价层电子对数=2+ ![]() (6﹣2×2)=3,S原子采取sp2杂化;S元素与C元素形成分子为CS2 , 与二氧化碳互为等电子体,结构式为S=C=S,空间构型为直线型,所以答案是:sp2;直线型;(3)二氧化碳形成分子晶体,二氧化硅形成原子晶体,故二氧化碳晶体熔点比较二氧化硅低, 所以答案是:低;晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;(4)往硫酸铜溶液中逐滴加入过量氨水,先生成氢氧化铜沉淀,后氢氧化铜溶解氨水得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液,所以答案是:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;(5)由Cu晶体的堆积方式可知,为面心立方密堆积,以顶角Cu原子研究,与之最近的Cu原子处于面心,每个顶点为12个面共用,故晶胞中Cu原子的配位数为12,晶胞中Cu原子数目=8×
(6﹣2×2)=3,S原子采取sp2杂化;S元素与C元素形成分子为CS2 , 与二氧化碳互为等电子体,结构式为S=C=S,空间构型为直线型,所以答案是:sp2;直线型;(3)二氧化碳形成分子晶体,二氧化硅形成原子晶体,故二氧化碳晶体熔点比较二氧化硅低, 所以答案是:低;晶体类型不同,二氧化碳形成分子晶体,二氧化硅形成原子晶体;(4)往硫酸铜溶液中逐滴加入过量氨水,先生成氢氧化铜沉淀,后氢氧化铜溶解氨水得到四氨合铜络离子,观察到的现象为:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液,所以答案是:先生成蓝色沉淀,后沉淀溶解生成深蓝色溶液;(5)由Cu晶体的堆积方式可知,为面心立方密堆积,以顶角Cu原子研究,与之最近的Cu原子处于面心,每个顶点为12个面共用,故晶胞中Cu原子的配位数为12,晶胞中Cu原子数目=8× ![]() +6×
+6× ![]() =4,Cu原子半径为r,晶胞棱长=4r×
=4,Cu原子半径为r,晶胞棱长=4r× ![]() =2
=2 ![]() r,故晶胞体积=(2
r,故晶胞体积=(2 ![]() r)3=16
r)3=16 ![]() r3 , 故晶胞的密度ρ=
r3 , 故晶胞的密度ρ= ![]() =
= ![]() =
= ![]() gcm﹣3 , 所以答案是:12;
gcm﹣3 , 所以答案是:12; ![]() .
.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】下列叙述不正确的是( )
A | B | C | D |
|
|
|
|
放电闪电时会发生反应:N2+O2═2NO | 利用丁达尔效应证明烧杯中的分散系是胶体 | 蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 | 加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
A.A
B.B
C.C
D.D
【题目】现有一瓶乙二醇和丙三醇的混和物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是( )
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度(g/cm3) | 溶解性 |
乙二醇 | C2H6O2 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.结晶法
B.萃取法
C.分液法
D.蒸馏法