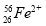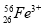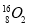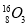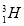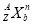题目内容
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是 ,可能有的阳离子是 。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为 。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为 。
(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H+
(3)9.6 g
(4)7.2 g
【解析】本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的铁要尽量多地耗酸,所以生成的是Fe3+,加入的Fe与Cu的质量比为7∶8,得到两者的物质的量之比为1∶1,根据Fe~4HNO3,3Cu~8HNO3可解得需金属的物质的量各为0.06 mol,从而可得金属的质量为7.2 g。