题目内容
下列离子方程式书写正确的是
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+ |
| C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓ |
| D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
B
试题分析:A. 浓盐酸有还原性,也会与酸性高锰酸钾溶液方式反应:2KMnO4+16HCl(浓) =" 2KCl+" 2MnCl2+ 5Cl2↑+8H2O,因此高锰酸钾溶液褪色不能证明是H2O2具有还原性。错误。B.酸性H2SO3>C6H5OH>HSO3-。所以将少量SO2通入苯酚钠溶液中,发生反应:2C6H5O-+SO2+H2O=2C6H5OH+SO32-。正确。C. 用硫氰化钾溶液可以检验溶液中的Fe3+:是因为发生反应Fe3++3SCN-=Fe(SCN)3Fe(SCN) 3是血红色能够溶于水的物质,不是沉淀。错误。D.I-、Fe2+都有还原性,所以向碘化亚铁溶液中通入过量的氯气,发生反应:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-.不符合客观事实。错误。

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
 2I-+SO42—+4H+
2I-+SO42—+4H+
 +2H2O
+2H2O 4OH-+O2↑
4OH-+O2↑ +4H+
+4H+
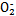 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。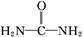 )与N
)与N HClO+OH-
HClO+OH- Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+