题目内容
取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出。试计算原混合液中Na2CO3和Na2SO4的物质的量浓度以及产生的气体在标准状况下的体积。
c(Na2SO4)=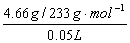 =0.40mol/L;
=0.40mol/L;
c(Na2CO3)= =1.0mol/L。在标准状况下生成1.12L CO2
=1.0mol/L。在标准状况下生成1.12L CO2
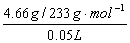 =0.40mol/L;
=0.40mol/L;c(Na2CO3)=
 =1.0mol/L。在标准状况下生成1.12L CO2
=1.0mol/L。在标准状况下生成1.12L CO2题中反应关系:BaCl2+Na2CO3=BaCO3↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,知剩余白色固体为BaSO4。
14.51g白色沉淀为BaSO4和BaCO3的混合物,其中不溶于稀硝酸的是4.66g BaSO4,则BaCO3质量为:
14.51g-4.66g=9.85g。
c(Na2SO4)=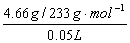 =0.40mol/L;
=0.40mol/L;
c(Na2CO3)= =1.0mol/L。
=1.0mol/L。
设生成标准状况下的CO2气体体积为xL。
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
1mol 22.4L
9.85/197mol xL
x=1.12,即在标准状况下生成1.12L CO2
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,知剩余白色固体为BaSO4。
14.51g白色沉淀为BaSO4和BaCO3的混合物,其中不溶于稀硝酸的是4.66g BaSO4,则BaCO3质量为:
14.51g-4.66g=9.85g。
c(Na2SO4)=
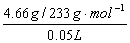 =0.40mol/L;
=0.40mol/L;c(Na2CO3)=
 =1.0mol/L。
=1.0mol/L。设生成标准状况下的CO2气体体积为xL。
BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
1mol 22.4L
9.85/197mol xL
x=1.12,即在标准状况下生成1.12L CO2

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ( )
( ) 个数为0.1 NA
个数为0.1 NA