题目内容
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.O | D.Ar |
C
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列含有共价键的离子化合物是
| A.NH4Cl | B.H2O | C.N2 | D.MgCl2 |
下列说法正确的是
| A.NH4Cl为共价化合物 |
| B.N2分子中含有一对共用电子对 |
| C.Na2O2既含有离子键又含有非极性键 |
| D.电解水与电解熔融NaCl时破坏的化学键类型相同 |
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断正确的是 ( )。
| A.PH3分子呈平面三角形 |
| B.PH3分子是极性分子 |
| C.PH3沸点低于NH3沸点,因为P—H键键能低 |
| D.PH3分子稳定性低于NH3分子,因为NH3分子之间存在氢键 |
CO2、CH4、BF3都是非极性分子,HF、H2O、NH3都是极性分子,由此推测ABn型分子是非极性分子的经验规律正确的是( )。
| A.所有原子在同一平面 |
| B.分子中每个键的键长应相等 |
| C.在ABn中A原子没有孤对电子 |
| D.A的相对原子质量小于B |
下列各组物质中,所有化学键都是共价键的是( )。
| A.H2S和Na2O2 | B.H2O2和CaF2 |
| C.NH3和N2 | D.HNO3和NaCl |
下列说法正确的是( )。
| A.键角决定了分子的结构 |
| B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定 |
| C.CH4、CCl4中键长相等,键角不同 |
D.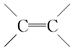 中的键能是C—C中的键能的两倍 中的键能是C—C中的键能的两倍 |
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A.NH4+为正四面体形 | B.CS2为直线形 |
| C.HCN为折线形(V形) | D.PCl3为三角锥形 |
