题目内容
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
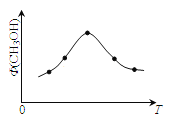
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H_____0(填“>”、“<”、“=”)
(3)上述反应在实际生产中采用的温度是300℃,其目的是_________________。
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
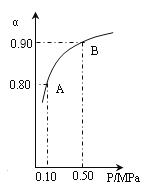
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_______________(保留一位小数)。
【答案】BC<加快反应速率,使催化剂活性最高CD22.7g/mol
【解析】
(1)根据平衡状态的含义分析;
(2)根据甲醇含量与温度关系分析;
(3)根据温度与反应速率和催化剂活性关系分析;
(4)①根据压强与反应速率及平衡关系分析;
②根据B点的平衡转化率为0.8结合平均相对分子质量的含义计算。
解析:(1)A.CO2和CH3OH的浓度相等不能说明正逆反应速率是否相等,不一定是平衡状态,A错误; B.H2的百分含量保持不变,说明是平衡状态,B正确;C.正反应体积减小,容器内压强保持不变 ,说明是平衡状态,C正确;D.3v正(H2)=v逆(H2O) 不满足反应速率之比是相应的化学计量数之比,因此没有达到平衡状态,D错误;E.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器中混合气体的密度保持不变不能说明反应达到平衡状态,E错误,答案选BC;
(2)随着温度的升高甲醇含量增加,反应向正反应方向进行;达到最高后说明达到平衡状态,继续升高温度甲醇含量降低,说明升高温度平衡向逆反应方向进行,正反应是放热反应;
(3)采用300℃的温度,可以加快反应速率,且催化剂活性较高;
(4)合成塔中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①A.体积压缩,反应混合物各组分浓度均增大,A错误;B.体积压缩,压强增大,正、逆反应速率都增大,B错误;C.CO2和H2按1:3的体积比投入,且二者按物质的量1:3反应,反应体系中CO2和H2的体积比始终为1:3,C正确;D.压缩体积,增大压强,平衡正向移动,氢气的体积分数减小,D正确,答案选CD;
②设CO2和H2分别是1mol、3mol。由图可知,0.5MPa条件下CO2的平衡转化率为0.9,可知反应的CO2为0.9mol,根据方程式可知参加反应氢气物质的量为0.9mol×3=2.7mol,生成甲醇和水蒸气分别是0.9mol、0.9mol,所以混合气体的平均摩尔质量是![]() 。
。

