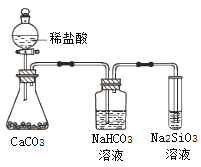
题目内容
【题目】U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素。U为非金属元素,且U与X同主族;V与X两元素的最高正化合价之和为6;W与Y同主族;X的周期数是族序数的3倍;Y的最外层电子数是最内层电子数的3倍。
请推测出U、V、W、X、Y和Z六种元素,并用相应的化学用语或者.化学符号回答下列问题:
(1)V的原子结构示意图为___,W、X、Y三种元素的原子半径由大到小的顺序为___。
(2)物质VU4Z的电子式为___,存在的化学键有___。
(3)U与W能形成的18e-分子的结构式为___,W的化合价为___。
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子含有相同的电子数,且在水溶液中、加热条件下能够发生反应生成含相同电子数的两种分子,该反应的离子方程式为___。
(5)加热搅拌条件下,XZW3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1molXZW3时,转移6mole-,其离子方程式是___。
【答案】 r(Na)>r(S)>r(O)(或Na>S>O)
r(Na)>r(S)>r(O)(或Na>S>O) ![]() 离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”) H-O–O-H -1价 NH4++OH-
离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”) H-O–O-H -1价 NH4++OH-![]() NH3↑+H2O 6Fe2++6H++ClO3-
NH3↑+H2O 6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
【解析】
U、V、W、X、Y和Z为原子序数依次增大的六种短周期元素,X的周期数是族序数的3倍,故X为Na元素;U为非金属元素,且U与X同主族,U为H元素;V与X两元素的最高正化合价之和为6,Na元素最高正化合价为1,所以V的最高正价为+5,即V在第VA族,又V的原子序数比Na小,所以V为N元素;Y为第三周期元素,又Y的最外层电子数是最内层电子数的3倍,所以Y为S元素;W与Y同主族,故W为O元素,Z的原子序数比S大且Z为短周期元素,所以Z为Cl元素,故U、V、W、X、Y和Z分别为H、N、O、Na、S、Cl六种元素,据此分析解答此题。
由分析可知,U、V、W、X、Y和Z分别为H、N、O、Na、S、Cl六种元素。
(1)V为N元素,核内有7个质子,核外有7个电子,最外层有5个电子,原子结构示意图为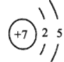 ;原子的电子层数越多,半径越大,电子层数相同的原子,核内质子数越多,半径越小,W、X、Y分别是O、Na、S,电子层数分别为2、3、3,质子数分别为8、11、16,故O、Na、S三种元素的原子半径由大到小的顺序为:r(Na)>r(S)>r(O)(或Na>S>O);
;原子的电子层数越多,半径越大,电子层数相同的原子,核内质子数越多,半径越小,W、X、Y分别是O、Na、S,电子层数分别为2、3、3,质子数分别为8、11、16,故O、Na、S三种元素的原子半径由大到小的顺序为:r(Na)>r(S)>r(O)(或Na>S>O);
(2)物质VU4Z的化学式为NH4Cl,属于离子化合物,由阴阳离子以离子键构成,电子式为:![]() ;NH4Cl中铵根离子与氯离子之间为离子键,铵根中氮原子和氢原子之间为极性共价键,答案为:
;NH4Cl中铵根离子与氯离子之间为离子键,铵根中氮原子和氢原子之间为极性共价键,答案为:![]() ;离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”);
;离子键和共价键(或“离子键和极性键”或“离子键和极性共价键”);
(3)U与W即H与O元素,形成的常见化合物有H2O、H2O2,其中H2O2为18电子分子,结构式为H–O–O–H,其中H为+1价,O为-1价,答案为:H–O–O–H;-1价;
(4)W和U两元素形成的阴离子与V和U两元素形成的阳离子分别是OH-和NH4+,OH-和NH4+在加热的条件下生成NH3和H2O,OH-、NH4+、NH3、H2O都含有10个电子,都属于10电子微粒,反应的离子方程式为:NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(5)XZW3为HClO3,HClO3能将强酸性溶液中的Fe2+氧化成Fe3+,当消耗1mol HClO3时,转移6mole-,即一个氯原子得到6个电子,HClO3中Cl 为+5价,得到6个电子变成-1价的Cl-,根据得失电子守恒和电荷守恒,该反应的离子方程式为:6Fe2++6H++ClO3-![]() 6Fe3++Cl-+3H2O。
6Fe3++Cl-+3H2O。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】有X、Y、Z、W、Q五种短周期元素在周期表中的相对位置如下所示,其中Z原子的核外电子数是其价电子数的3倍,Q的一种核素没有中子。
X | Y | |
Z | W |
请回答下列问题:
(1)元素W在元素周期表中的位置是___________________________;
(2)画出Z的原子结构示意图______________;QXY的电子式为_________________;
(3)Y的最高价氧化物的化学式为_________;
(4)W和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为_________________;
(5) (XY)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________。