题目内容
【题目】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)![]() CH3OH(l) △H=________ kJ/mol。
CH3OH(l) △H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有(______)
a.增大起始通入![]() 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,増大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) ![]() CH3OH(g)已经达到平衡状态的是(______)
CH3OH(g)已经达到平衡状态的是(______)
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衝转化率如图所示:
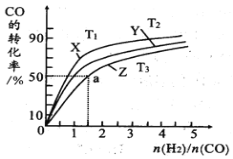
①温度T1°C、T2°C和T3°C由高到低的順序为:_________________;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________,该反应的压强平衡常数Kp的计算式为__________。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
【答案】-128.1 CE AC T3>T2>T1 1:1 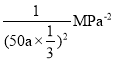
【解析】
(1)三种物质燃烧的热化学方程式为:H2(g)+1/2O2(g)=H2O(l) H=-285.8kJ/mol ①
CO(g)+1/2O2(g)=CO2(g) H=-283.0kJ/mol ②
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) H=-726.5kJ/mol ③
则①×2+②-③得:CO(g)+2H2(g)![]() CH3OH(l) △H=-128.1kJ/mol。
CH3OH(l) △H=-128.1kJ/mol。
答案为-128.1
(2) a.增大起始通入![]() 值,不一定能增大反应物浓度,反应速率不一定加快;
值,不一定能增大反应物浓度,反应速率不一定加快;
b.恒温恒容,再通入氦气,反应物和生成物的浓度都未变,速率不变;
c.使用新型的高效正催化剂,可加快反应速率;
d.将产生的甲醇及时移走,能增大反应物的转化率,但不能加快反应速率;
e.压缩体积,増大压强,可加快反应速率。
故答案为CE。
(3) a.体系中碳氢单键数目不再改变,说明甲醇的量不再改变,反应达平衡状态;
b.若起始投入量之比等于化学计量数之比,则体系中n(CO):n(H2)始终不变,不一定达平衡状态;
c.因反应前后气体分子数不等,所以体系中压强或者平均摩尔质量不再改变,说明反应达平衡状态;
d.单位时间内消耗氢气和CH3OH的物质的量不可能相等,错误。
故答案为AC。
(4) ①因为正反应为放热反应,所以温度越高,反应物的转化率越小。从图中可以看出,相同投料比时,CO的转化率Z<Y<X ,所以T3>T2>T1。答案为T3>T2>T1。
②起始反应物投料比n(H2)/n(CO)=1.5,可设n(H2)=3mol,n(CO)=2mol,
2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
起始量 3mol 2mol 0
变化量 2mol 1mol 1mol
平衡量 1mol 1mol 1mol
则平衡时CO和CH3OH的分压之比为1:1。答案为1:1;
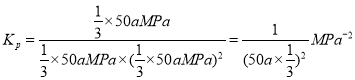
答案为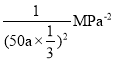 。
。

 口算题天天练系列答案
口算题天天练系列答案【题目】下表为元素周期表的一部分,用元素符号或化学式完成各小题。
IA | ⅡА | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ||||
4 | ② | ④ | ⑩ |
(1)化学性质最不活泼的元素__________________,非金属性最强的元素是___________________。最稳定的气态氢化物是___________________;最高价氧化物对应水化物酸性最强的是_____________________________________________。
(2)金属性最强的单质与水反应的离子方程式为______________。
(3)③⑦⑧⑨四种元素的简单离子半径由大到小的顺序为_________________。
(4)分别写出⑥、⑦和氢形成的气态氢化物的结构式___________________。
(5)用电子式表示②的氧化物的形成过程____________________________。


