题目内容
【题目】碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以MezTeCMe表 示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。
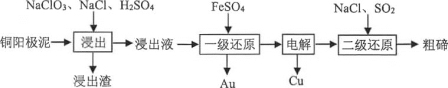
①浸出液的主要成分为CuSO4、HAuCu、H2TeO3,则浸出渣的主要成分 为____(填化学式);“浸出”过程中有少量污染性气体生成,该气体是_______(填物质名称)
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为_________。
③欲得到64g碲,则“二级还原”过程中至少需通入____mol SO2。 “氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3和Cu(OH)2,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为______。
②电解过程中,阴极的电极反应式为______。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是____(任写一点)
【答案】PbSO4和AgCl 氯气 [AuCl4]- + 3Fe2+ = 3Fe3+ + Au + 4Cl- 1 Cu2Te + 2O2 + 2NaOH + H2O = Na2TeO3 + 2Cu(OH)2 TeO32- + 4e- + 3H2O = Te + 6OH- 不生成氯气等污染性气体(或工艺简单)
【解析】
(1)①Pb和Ag被氧化成Pb2+和Ag+,随后分别与SO42-和Cl-形成沉淀PbSO4和AgCl,浸出渣的主要成分为PbSO4和AgCl。NaCl中Cl-与溶液中的氧化得到的少量Au3+络合,形成四氯合金离子([AuCl4]-),促进Au的溶解,同时使Ag+沉淀。NaClO3和NaCl反应生成氯气Cl2,故“浸出”过程中需要进行尾气处理的污染性气体是Cl2。
②“一级还原”过程中发生反应的离子方程式为:[AuCl4]-+3Fe2+=3Fe3++Au↓+4Cl-;
③H2TeO3→Te,Te元素化合价变了4价,SO2→SO42-,硫元素化合价变了2价,根据得失电子守恒有0.5mol×4=n(SO2)×2(其中64g的碲为0.5mol),解得n(SO2)=1mol。
(2)①在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,化学方程式为Cu2Te+2O2+2NaOH+H2O=Na2TeO3+2Cu(OH)2。
②若用惰性电极电解溶液,在阴极上TeO32-得到电子生成Te,电极反应式为TeO32-+4e-+3H2O=Te+6OH-。
③与“氯化浸出-还原法”相比,“氧化碱浸-电解法”的优点是如不产生氯气等污染性气体,反应步骤少,简便,成本低等。
(1)①Pb和Ag被氧化成Pb2+和Ag+,随后分别与SO42-和Cl-形成沉淀PbSO4和AgCl,浸出渣的主要成分为PbSO4和AgCl。NaCl中Cl-与溶液中的氧化得到的少量Au3+络合,形成四氯合金离子([AuCl4]-),促进Au的溶解,同时使Ag+沉淀。NaClO3和NaCl反应生成氯气Cl2,故“浸出”过程中需要进行尾气处理的污染性气体是Cl2。
②“一级还原”过程中发生反应的离子方程式为:[AuCl4]-+3Fe2+=3Fe3++Au↓+4Cl-;
③H2TeO3→Te,Te元素化合价变了4价,SO2→SO42-,硫元素化合价变了2价,根据得失电子守恒有0.5mol×4=n(SO2)×2(其中64g的碲为0.5mol),解得n(SO2)=1mol。
(2)①在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,化学方程式为Cu2Te+2O2+2NaOH+H2O=Na2TeO3+2Cu(OH)2。
②若用惰性电极电解溶液,在阴极上TeO32-得到电子生成Te,电极反应式为TeO32-+4e-+3H2O=Te+6OH-。
③根据以上分析可知与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是如不产生氯气等污染性气体,反应步骤少,简便,成本低等。