题目内容
17.下列溶液中通入大量的CO2气体一定会产生浑浊现象的是( )①氯化钙溶液 ②澄清的石灰水 ③碳酸钠溶液
④偏铝酸钠溶液 ⑤硅酸钠溶液 ⑥次氯酸钙溶液.
| A. | ①②④⑤⑥ | B. | ②③④⑤⑥ | C. | ④⑤ | D. | ③④⑤ |
分析 先判断反应是否发生,再根据生成物的溶解性进行判断,难溶性的物质会产生沉淀,白色沉淀有:硅酸、碳酸氢钠晶体、难溶的碳酸盐等,以此解答.
解答 解:①盐酸的酸性强于碳酸,所以氯化钙溶液与二氧化碳不反应,故错误,
②大量的CO2与澄清石灰水反应生成碳酸氢钙,没有沉淀生成,故错误;
③大量的CO2与饱和Na2CO3溶液反应生成溶解度更小的NaHCO3,由沉淀生成,但碳酸钠溶液不是饱和溶液,所以无沉淀生成,故错误;
④碳酸酸性强于氢氧化铝,过量的二氧化碳可与NaAlO2溶液反应NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓,最终会出现氢氧化铝沉淀,故正确;
⑤向Na2SiO3溶液中通入过量CO2会生成硅酸沉淀,故正确;
⑥向Ca(ClO)2溶液通入过量CO2会生成次氯酸和碳酸氢钙,没有沉淀,故错误;
故选C.
点评 本题考查物质之间的化学反应,掌握元素及其化合物的性质,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意注意通入的过量二氧化碳能否与产物继续反应是该题易错点,题目难度不大.

练习册系列答案
相关题目
11.配制250mL 0、1000mol/LNaCl溶液时,下列操作会使配得溶液中NaCl的物质的量浓度偏大的是( )
| A. | 移液后未洗涤烧杯 | |
| B. | 在容量瓶中进行定容时,仰视刻度线 | |
| C. | 在容量瓶中进行定容时,俯视刻度线 | |
| D. | 定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
5.一定温度下,在容积为3L的密闭容器内发生反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,起始时充入1mol CO和1mol H2O(g),2min后反应达到平衡状态,此时CO2的浓度为0.2mol•L-1,下列说法正确的是( )
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
2.下列物质分类正确的是( )
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 福尔马林、水玻璃、氨水均为混合物 |
9.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 异戊烷 | B. | 异戊二烯 | C. | 邻二甲苯 | D. | 萘 |
6.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Q与W能形成10电子,不能形成14电子、18电子分子 | |
| B. | Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 | |
| C. | Y、Z、Q分别与X化合,只能形成AB2型化合物 | |
| D. | X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色 |
7.下列有关实验的做法错误的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 用NaOH固体配制100mL 1mol•L-1的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶 | |
| C. | 配制一定物质的量浓度溶液过程中,玻璃棒的作用主要是搅拌和引流 | |
| D. | 容量瓶在使用前要检查是否漏水,若瓶内残留蒸馏水会导致所得溶液浓度偏低 |
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯(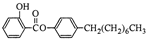 )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑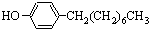 ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
. 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.