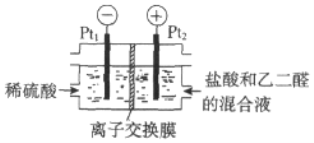
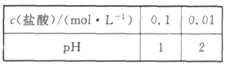
题目内容
【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%
【答案】D
【解析】
试样含Fe2O3、Cu、Fe,加盐酸生成气体B为氢气,Fe与盐酸反应、氧化铁与盐酸反应,且Cu与氯化铁反应,则溶液A中含H+、Fe3+、Fe2+、Cu2+,加过氧化氢可氧化亚铁离子,溶液C调节pH可使铁离子转化为沉淀,则沉淀E为Fe(OH)3,结合Fe原子守恒可计算Fe的质量,溶液D中含氯化铜,以此来解答。
A.Fe与盐酸反应生成气体B为氢气,故A正确;
B.由上述分析可知,A中所含的阳离子可能是H+、Fe3+、Fe2+、Cu2+,故B正确;
C.加入过氧化氢溶液时,发生氧化还原反应,离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,故C正确;
D.若沉淀E经洗涤、烘干、灼烧后得到固体mg,Fe(OH)3的质量为mg,若Cu与氯化铁恰好反应,由原子守恒可知,试样中Cu的质量分数可能为![]() ×100%,但Cu不一定恰好与氯化铁反应,因此无法计算,故D错误;
×100%,但Cu不一定恰好与氯化铁反应,因此无法计算,故D错误;
故答案为D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目