题目内容
8.25℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )| A. | 饱和氯化钾溶液中:c(K+)+c(H+)=c(Cl-)+c(OH-) | |
| B. | pH=11的氨水中:c(OH-)=3.0mol•L-1 | |
| C. | 饱和苏打溶液中:c(Na+)=c(CO32-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
分析 A.根据溶液中的电荷守恒判断;
B.常温下pH=11的溶液中c(H+)=1.0×10-11mol•L-1,结合常温下水的离子积计算出氢氧根离子的浓度;
C.苏打为碳酸钠溶液,碳酸根离子部分水解,导致碳酸根离子浓度减小,由于水解程度较小,则c(Na+)<c(CO32-);
D.常温下pH=12 的溶液中氢离子浓度为1.0×10-12mol•L-1,结合水的离子积计算出溶液中氢氧根离子浓度.
解答 解:A.饱和氯化钾溶液中,根据电荷守恒可得:c(K+)+c(H+)=c(Cl-)+c(OH-),故A正确;
B.常温下pH=11的溶液中c(H+)=1.0×10-11mol•L-1,则该溶液中氢氧根离子浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-11}}$mol/L=1.0×10-3mol•L-1,故B错误;
C.饱和苏打溶液中,碳酸根离子部分水解,导致碳酸根离子的浓度减小,但是碳酸根离子的水解程度较小,则正确的浓度关系为:c(Na+)<c(CO32-),故C错误;
D.常温下pH=12 的溶液中氢离子浓度为1.0×10-12mol•L-1,则c(OH-)=$\frac{1×1{0}^{-14}}{1×1{0}^{-12}}$mol/L=1.0×10-2mol•L-1,故D正确;
故选AD.
点评 本题考查了溶液中离子浓度大小的判断,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,试题有利于提高学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.在光照条件下,将1molCH4与Cl2反应,得到等物质的量的4种取代物,则耗Cl2物质的量为( )
| A. | 1mol | B. | 2mol | C. | 2.5mol | D. | 10mol |
19.下列说法中错误的是( )
| A. | 硅是人类将太阳能转化为电能的常用材料 | |
| B. | 硝酸工业NO循环利用,理论上每摩尔氨气可生成1摩尔硝酸 | |
| C. | 普通食醋中含有3%~5%的醋酸 | |
| D. | 日本核泄漏产生53131I原子,其中子数比 55134Cs的中子数少2 |
16.在酸性无色溶液中,下列各离子组能大量共存的是( )
| A. | K+、Na+、SO42-、Cl- | B. | Cu2+、Al3+、Cl-、SO42- | ||
| C. | Fe2+、I-、Cl-、CO32- | D. | Ag+、Na+、NO3-、Cl- |
13.下列式子书写正确的是( )
| A. | 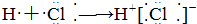 | B. | 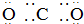 | ||
| C. | 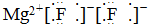 | D. |  |
20.火箭发射时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成氮气和水蒸气.已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7KJ/mol
N2H4(g)+O2(g)=N2 (g)+2H2O(g)△H=-534KJ/mol
则1摩尔气体肼和NO2完全反应时放出的热量为( )
N2(g)+2O2(g)=2NO2(g)△H=+67.7KJ/mol
N2H4(g)+O2(g)=N2 (g)+2H2O(g)△H=-534KJ/mol
则1摩尔气体肼和NO2完全反应时放出的热量为( )
| A. | 100.3KJ | B. | 567.85KJ | C. | 500.15KJ | D. | 601.7KJ |
16.现有四份200ml 4mol/L的氢氧化钠溶液分别与下列四种X溶液反应,其中化学反应速率最大的是( )
| A. | 10℃,20ml,3mol/L的X溶液 | B. | 20℃,10ml,5mol/L的X溶液 | ||
| C. | 20℃,30ml,2mol/L的X溶液 | D. | 10℃,10ml,2mol/L的X溶液 |