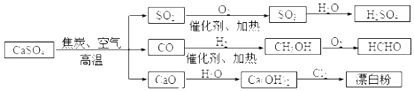
题目内容
【题目】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
(1)Cu2+基态的电子排布式可表示为;
(2)SO42﹣的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42﹣互为等电子体的分子的化学式:;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 .
(5)CuS比CuO的熔点(填高或低),原因是 .
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为(列式并计算),a位置S2﹣离子与b位置Zn2+离化学﹣选修5:有机化学基础子之间的距离为pm(列式表示). 
【答案】
(1)1s22s22p63s23p63d9(或[Ar]3d9)
(2)正四面体;sp3;CCl4或SiCl4
(3)
(4)在相同温度下,Ksp(CuS)<Ksp(ZnS),或相同温度下,CuS比ZnS更难溶
(5)低;CuO晶格能比CuS大
(6)![]() ?=4.1g/(cm)3;
?=4.1g/(cm)3;![]()
【解析】解:(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1 , Cu2+基态的电子排布式可表示为1s22s22p63s23p63d9 , 所以答案是:1s22s22p63s23p63d9;(2)SO42﹣的价电子对数= ![]() =4,形成四条杂化轨道,S原子的杂化方式为sp3 , 形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42﹣互为等电子体的微粒有SiCl4等;
=4,形成四条杂化轨道,S原子的杂化方式为sp3 , 形成四面体结构,价电子对数=孤电子对数+配位原子数,可知孤电子对数为0,所以为正四面体结构;具有相同原子数和价电子数的微粒互称为等电子体,所以与SO42﹣互为等电子体的微粒有SiCl4等;
所以答案是:正四面体;sp3;SiCl4;(3)[Cu(OH)4]2﹣中与Cu2+与4个OH﹣形成配位键,可表示为  ,所以答案是:
,所以答案是:  ;(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;所以答案是:在相同温度下,Ksp(CuS)<Ksp(ZnS);(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2﹣比S2﹣半径小,所以CuO的熔点比CuS高;
;(4)由沉淀转化原理可知溶度积大的沉淀转化为溶度积小的沉淀容易实现,在相同温度下,Ksp(CuS)<Ksp(ZnS),所以ZnS能转化为CuS;所以答案是:在相同温度下,Ksp(CuS)<Ksp(ZnS);(5)离子晶体中离子半径越小,离子所带电荷越多,离子键越强,晶格能越大,熔点越高,CuS与CuO中O2﹣比S2﹣半径小,所以CuO的熔点比CuS高;
所以答案是:低;CuO晶格能比CuS大;(6)黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数= ![]() ×8+
×8+ ![]() ×6=4,ρ=
×6=4,ρ= ![]() =
= ![]() =4.1g/(cm)3 , 每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270
=4.1g/(cm)3 , 每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270 ![]() pm,设S2﹣离子与Zn2+离子之间的距离为x,2x2﹣2x2cos109°28′=(270
pm,设S2﹣离子与Zn2+离子之间的距离为x,2x2﹣2x2cos109°28′=(270 ![]() )2 , x=
)2 , x= ![]() pm;所以答案是:4.1g/(cm)3;
pm;所以答案是:4.1g/(cm)3; ![]() .
.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案