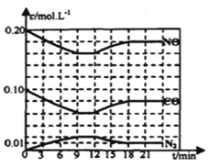
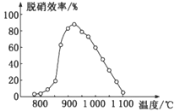
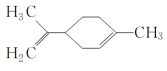
题目内容
【题目】下列说法正确的是
A.常温下,向稀醋酸溶液中缓慢通入NH3,溶液中 的值增大
的值增大
B.298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C.标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
【答案】B
【解析】
A.对表达式稍作变形得到![]() ,因温度没变故K值不变,在通入氨气的过程中溶液逐渐变为醋酸铵溶液,醋酸铵是强电解质可以完全电离,因此溶液中的
,因温度没变故K值不变,在通入氨气的过程中溶液逐渐变为醋酸铵溶液,醋酸铵是强电解质可以完全电离,因此溶液中的![]() 在增大,则
在增大,则![]() 减小,A项错误;
减小,A项错误;
B.该反应是气体分子数减小的熵减反应,却能在室温下自发进行,说明其吉布斯自由能![]() 在298K时小于0,
在298K时小于0,![]() 必须为负才有可能实现,故反应放热,B项正确;
必须为负才有可能实现,故反应放热,B项正确;
C.氯气通入碱中发生歧化反应![]() ,标出化合价后不难发现1mol氯气在反应中只转移1mol电子,标况下22.4L氯气中有1mol氯气,则一共转移1mol电子,C项错误;
,标出化合价后不难发现1mol氯气在反应中只转移1mol电子,标况下22.4L氯气中有1mol氯气,则一共转移1mol电子,C项错误;
D.醋酸是弱酸,溶液中只有小部分醋酸分子能电离产生![]() ,因此相同
,因此相同![]() 浓度下的醋酸要比盐酸的浓度大,在中和等量
浓度下的醋酸要比盐酸的浓度大,在中和等量![]() 时需要的醋酸体积更少,D项错误;
时需要的醋酸体积更少,D项错误;
答案选B。

【题目】回答下列问题:
(1)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | Mn | Fe | |
电离能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子轨道排布图:_________________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是________________________________________________________
(2)下表是第三周期部分元素的电离能[单位:[![]() (电子伏特)]数据。
(电子伏特)]数据。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列说法正确的是___________(填序号)。
A.甲的金属性比乙强 B.乙有![]() 价
价
C.丙不可能为非金属元素 D.丁一定为金属元素
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,氧化性最强的单质是___,还原性最强的单质是___。
<>(2)最高价氧化物的水化物中碱性最强的是___,酸性最强的是___,呈两性的是___。(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___。
(4)在B、C、E、F、G、H中,原子半径最大的是___。
(5)用电子式表示B和H组成化合物的形成过程___,它属于___化合物(填“离子”或“共价”)。
(6)写出B的最高价氧化物的水化物和H的单质反应的离子方程式:___。