题目内容
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
AD
试题分析:分析1、2组数据可知,金属的质量之比等于对应NO的体积之比,说明1、2组金属完全反应,第3组金属若完全反应,可得NO体积为
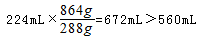 ,故第3组金属有剩余,硝酸完全反应。第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2,第3组生成的NO的物质的量为
,故第3组金属有剩余,硝酸完全反应。第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2,第3组生成的NO的物质的量为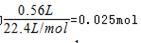 ,由反应
,由反应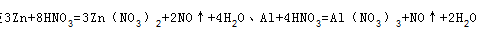 可知,起氧化剂作用的硝酸为总的硝酸的1 4 ,故25mL硝酸溶液中
可知,起氧化剂作用的硝酸为总的硝酸的1 4 ,故25mL硝酸溶液中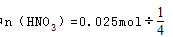 =0.1mol,原硝酸溶液的浓度为
=0.1mol,原硝酸溶液的浓度为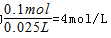 。起酸性作用的硝酸的物质的量为0.1mol-0.025mol=0.075mol,
。起酸性作用的硝酸的物质的量为0.1mol-0.025mol=0.075mol,令144mg合金中Mg、Al的物质的量分别为xmol、ymol,由二者质量与转移电子数目守恒有:
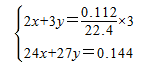 解得x=0.0015,y=0.004,故864mg合金中Al的物质的量
解得x=0.0015,y=0.004,故864mg合金中Al的物质的量 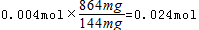 ,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为
,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为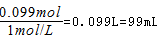 ,故选AD。
,故选AD。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 Na2S + 4CO↑ ②Na2SO4 + 4CO
Na2S + 4CO↑ ②Na2SO4 + 4CO ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
 )所含的中子数和电子数分别为8NA、9NA
)所含的中子数和电子数分别为8NA、9NA