题目内容
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
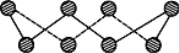
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______;
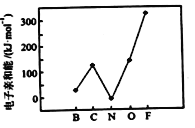
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______;氮元素的E1呈现异常的原因是________。
(3)Se原子序数为_______,其核外M层电子的排布式为_________;
(4)H2Se的稳定性比H2S_____________(填“强”或“弱”)。SeO3分子的立体构型为______。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_________。
【答案】sp3 非金属性增强,得电子时释放的能量依次增大 氮元素2p轨道为半满状态,较稳定,第一亲和能较低 34 3s23p63d10 弱 平面三角形 Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定
【解析】
(1)在S8中,S原子的价层电子对数为4,由此得出S采用的轨道杂化方式。
(2)除氮元素外,其他元素非金属性越强,第一亲和能E1越大;氮元素的2p轨道半充满,电子能量低,原子稳定。
(3)Se比S多18个电子,由此可得出原子序数及核外M层电子的排布式。
(4)Se比S的非金属性弱,则可得出H2Se与H2S的稳定性关系。SeO3分子中S原子的价层电子对数为3,由此可得出立体构型。
(5)从原子核外轨道中的电子排布,可确定Fe2+易被氧化成Fe3+的原因。
(1)在S8中,S原子的价层电子对数为4,则S采用的轨道杂化方式sp3。答案为:sp3;
(2)除氮元素外,其他元素非金属性越强,第一亲和能E1越大,其原因是非金属性增强,得电子时释放的能量依次增大;氮元素的2p轨道半充满,电子能量低,原子稳定,由此得出氮元素的E1呈现异常的原因是氮元素2p轨道为半满状态,较稳定,第一亲和能较低。答案为:非金属性增强,得电子时释放的能量依次增大;氮元素2p轨道为半满状态,较稳定,第一亲和能较低;
(3)Se比S多1个电子层,多18个电子,由此可得出原子序数为34,核外M层电子的排布式为3s23p63d10。答案为:34;3s23p63d10;
(4)Se比S的非金属性弱,则H2Se的稳定性比H2S弱。SeO3分子中S原子的价层电子对数为3,则立体构型为平面三角形。答案为:弱;平面三角形;
(5)从原子核外轨道中的电子排布,可确定Fe2+易被氧化成Fe3+的原因是Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定。答案为:Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定。