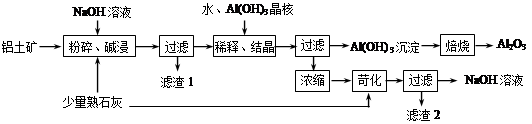题目内容
金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)将一小块金属钠投入盛有水的烧杯中,发生反应的化学方程式为 :
(2)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是 (填化学式,下同);适宜做耐火材料的是 ;
(3)金属铝既能与盐酸反应,又能与烧碱溶液反应,请写出金属铝与烧碱溶液反应的离子方程式: 。
(4)取少量FeCl2溶液,按图所示操作,使其跟NaOH溶液反应。 可观察到试管中出现白色絮状沉淀,继而变成灰绿色,最后变成红褐色,请写出与上述现象相关的反应的化学方程式: 、 。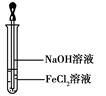
(5)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 (填序号)。
| A.有铜无铁 | B.有铁无铜 | C.铁、铜都有 | D.铁、铜都无 |
(1)2 Na + 2 H2O =2 NaOH + H2↑;
(2)Na2O2 (1分) Al2O3。
(3)2Al+2OH-+H2O ==2AlO2-+H2O
(4)FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(5)B
解析试题分析:(1)钠与水反应生成氢氧化钠和氢气,化学方程式为2 Na + 2 H2O =2 NaOH + H2↑;
(2)钠、铝、铁三种金属元素所形成的各种氧化物中具有强氧化性的是Na2O2,适宜做耐火材料的是Al2O3,铁的氧化物适宜做颜料;
(3)金属铝与烧碱溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+H2O ==2AlO2-+H2O;
(4)氢氧化钠与氯化亚铁溶液反应先生成白色沉淀,迅速变成灰绿色,最终成为红褐色,发生的化学方程式为FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl,4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(5)铁的还原性强于铜,所以铁先反应,只余铜或铁铜都余或铁铜都反应完都有可能,唯一不可能是有铁无铜,答案选B。
考点:考查化学方程式、离子方程式的书写,物质的用途,金属还原性强弱的判断

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:
(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。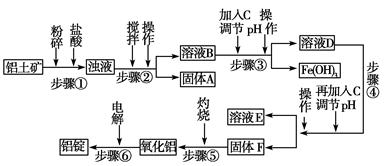
一些氢氧化物沉淀的pH如下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示: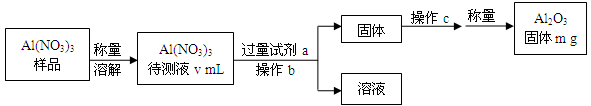
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示: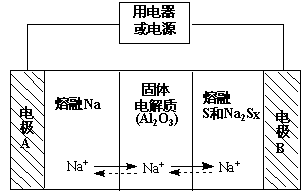
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c. 300℃~350℃ d. 350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx =" 2Na" + xS(3<x<5),则阳极的电极反应式为 。