题目内容
铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)与铁反应生成铜]。试写出该反应的化学方程式: _____________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:____________________________。
这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式: _________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)_________________ ___________。
(1)Fe+CuSO4=FeSO4+Cu
(2)2Cu+O2+H2O+CO2=Cu2(OH)2CO3
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3)选择铜做货币是因为铜的熔点比较低,容易铸造成型;铜的化学性质比较稳定,不易被腐蚀
解析

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案切开的金属Na暴露在空气中,其变化过程如下:
(1)反应Ⅰ的反应过程与能量变化的关系如下: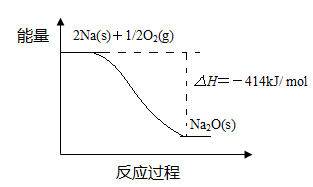
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
| A.升高温度,溶液的pH降低 |
| B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3) |
| C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大 |
| D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+) |
① 钠比锂活泼,用原子结构解释原因_______。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na
 Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。 (1)高温电解技术能高效实现CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意图如下:
①电极b发生 (填“氧化”或“还原”)反应。
②CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: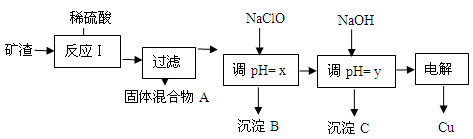
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a.加入NaClO可使溶液的pH降低
b.NaClO能调节pH的主要原因是由于发生反应ClO-+ H+
 HClO,ClO-消耗H+,从而达到调节pH的目的
HClO,ClO-消耗H+,从而达到调节pH的目的c.NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O
 HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的
HClO+OH-,OH-消耗H+ ,从而达到调节pH的目的⑤实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应: 。
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ | 1.9 7.0 | 3.2 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 ; ;劣质不锈钢腐蚀的实验现象 。
现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,
以下是以硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁αFe2O3)的生产流程示意图:
(1)步骤Ⅰ中过滤所得滤渣的主要成分是________。
(2)步骤Ⅱ中加入铁粉的目的是________。
(3)步骤Ⅲ中可选用________调节溶液的pH。
| A.稀硝酸 | B.双氧水 | C.氨水 | D.高锰酸钾溶液 |
(5)从滤液C中回收的主要物质的一种用途是_________________________________。