题目内容
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇。反应为![]() 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据如图:
某温度下,在容积为2L的密闭容器中进行该反应,其相关数据如图:
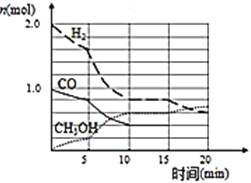
(1)从反应开始至平衡时,用CO表示化学反应速率为 ______ ,该温度下的平衡常数为 ______
(2)![]() 至10min时速率变化的原因可能是 ______ ;
至10min时速率变化的原因可能是 ______ ;
【答案】![]()
![]() 升高温度或使用了催化剂
升高温度或使用了催化剂
【解析】
由图可知10min到达平衡,平衡时甲醇为![]() ,则:
,则:
![]()
起始量![]() : 1 2 0
: 1 2 0
变化量![]() :
:![]()
![]()
![]()
平衡量![]() :
:![]()
![]()
![]()
则 ;平衡常数
;平衡常数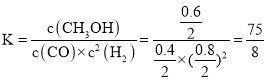 ;
;
故答案为:0.03mol/(Lmin);![]() ;
;
![]() 时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂;
时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂;
故答案为:反应受热或使用了催化剂。

练习册系列答案
相关题目
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)