题目内容
18.常温下,下列叙述中不正确的是( )| A. | NH4HSO4溶液中离子浓度大小关系:c(H+)>c(SO42-)>c(NH4+)>c(OH-) | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b=14 | |
| C. | Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
分析 A.硫酸氢铵在溶液中完全电离出氢离子和硫酸根离子,由于氢离子还来自水的电离,则c(H+)>c(SO42-),铵根离子比较部分水解,则c(SO42-)>c(NH4+);
B.pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,据此进行分析;
C.根据草酸钠溶液中的质子守恒判断;
D.根据碳酸氢钠溶液中的电荷守恒分析.
解答 解:A.NH4HSO4在溶液中完全电离出氢离子和硫酸根离子,由于氢离子还来自水的电离,则c(H+)>c(SO42-),铵根离子比较部分水解,则c(SO42-)>c(NH4+),则溶液中离子浓度大小关系为:c(H+)>c(SO42-)>c(NH4+)>c(OH-),故A正确;
B.pH=a的氢氧化钠溶液中c(NaOH)=c(OH-)=10a-14mol/L,醋酸部分电离,则pH=b的醋酸溶液中c(醋酸)>10-bmol/L,酸碱恰好中和,则酸的物质的量与碱的物质的量相等,则c(NaOH)=c(OH-)=10a-14mol/L=c(醋酸)>10-bmol/L,所以10a-14>10-b,则a+b>14,故B错误;
C.Na2C2O4溶液中存在质子守恒:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故C正确;
D.碳酸氢钠溶液中存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、电荷守恒、物料守恒及质子守恒的含义为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

| A. | CH3CH2OH 和CH3OCH3 | B. | 淀粉和纤维素 | ||
| C. | 金刚石和石墨 | D. | CH3CH2CH3和CH3CH2CH2CH3 |
| A. | S原子的结构示意图: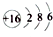 | B. | 氯化氢的电子式: | ||
| C. | 乙烯的结构式:CH2CH2 | D. | CH4分子的比例模型: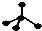 |
| A. | 化学反应能够制造出新的物质,同时也能制造出新的元素 | |
| B. | 实验室中少量金属钠、钾常保存在煤油中 | |
| C. | 葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假葡萄酒 | |
| D. | 向豆浆中加入硫酸钙会使蛋白质等聚沉制得豆腐 |
| A. | 组成上相差一个或若干个CH2原子团,且符合同一通式的有机物互称为同系物 | |
| B. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| C. | 蛋白质和油脂都属于高分子化合物,一定条件下均能水解 | |
| D. | 丙烷分子中所有原子不在同一平面上,但3个碳原子在同一直线上 |
| A. | 用如图装置除去乙烷中混有的乙烯 | |
| B. | 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大 | |
| C. | 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中 | |
| D. | 玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |
①用托盘天平称量时砝码放在左盘
②托盘天平的砝码上有一层铁锈
③将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
④定容时俯视刻度线
⑤定容时仰视刻度线
⑥干净的容量瓶未经干燥就用于配制溶液.
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤ | D. | ②③④ |
| 反应 | A | B | C | D |
| △Hl(kJ•mol-2) | 10.5 | 1.80 | -126 | -11.7 |
| △Sl(J•mol-1•K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
| A. | 溴化氢气体与氨气相遇反应 | B. | 氯化氢溶于水 | ||
| C. | 盐酸和NaOH溶液混合 | D. | 锌和稀硫酸反应 |