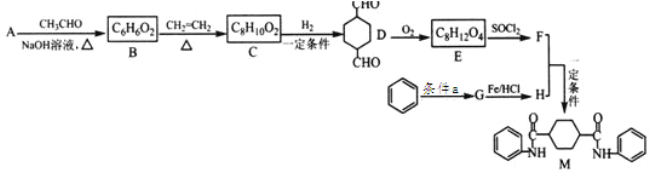
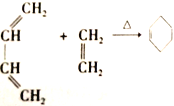
题目内容
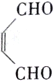
【题目】对于苯乙烯(结构简式为![]() )有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
)有下列叙述:①不能使酸性KMnO4 溶液褪色;②能使溴的四氯化碳溶液褪色;③不可溶于水;④可溶于苯中;⑤1mol苯乙烯最多能与4molH2发生加成反应;⑥所有的原子不可能共平面,其中正确的是
A. ②③④⑤ B. ①②⑤⑥ C. ②③④⑥ D. 全部正确
【答案】A
【解析】![]() 中含有苯环和碳碳双键,结合苯和乙烯的结构与性质分析判断。
中含有苯环和碳碳双键,结合苯和乙烯的结构与性质分析判断。
苯乙烯的结构简式为![]() :①含有碳碳双键,能使酸性KMnO4 溶液褪色,错误;②能使溴的四氯化碳溶液褪色,正确;③一般而言,烯烃难溶于水,
:①含有碳碳双键,能使酸性KMnO4 溶液褪色,错误;②能使溴的四氯化碳溶液褪色,正确;③一般而言,烯烃难溶于水,![]() 不可溶于水,正确;④根据相似相容原理,
不可溶于水,正确;④根据相似相容原理,![]() 可溶于苯中,正确;⑤苯环和碳碳双键均能与氢气加成,1mol
可溶于苯中,正确;⑤苯环和碳碳双键均能与氢气加成,1mol![]() 最多能与4molH2发生加成反应,正确;⑥苯环和碳碳双键均为平面结构,所有的原子可能共平面,错误;正确的有②③④⑤,故选A。
最多能与4molH2发生加成反应,正确;⑥苯环和碳碳双键均为平面结构,所有的原子可能共平面,错误;正确的有②③④⑤,故选A。

 作业辅导系列答案
作业辅导系列答案【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
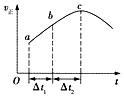
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件).
(2)探究反应条件对0.10mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
【题目】回答下列问题:
(1)下列反应属于放热反应的是_______。
A.铝片与稀H2SO4反应制取H2 B.碳酸钙高温分解成氧化钙和二氧化碳
C.葡萄糖在人体内氧化分解 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl固体反应
(2)一定条件下,SO2与O2反应5min后,若SO2和SO3物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为______;用SO3表示这段时间该化学反应速率为_______。
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从____处通入(填“a”或b”),电池内部H+向_____(填“左”或“右”)移动。写出正极的电极反应式________。

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N—H | N≡N |
键能kJ/mol | 436 | a | 945 |
已知:1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值_________。