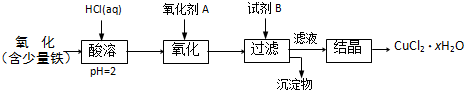
题目内容
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A>B;
②离子半径A>B;
③A的正价与B的负价绝对值一定相等;
④电负性A<B;
⑤电离能A>B
其中正确的组合是( )
①原子半径A>B;
②离子半径A>B;
③A的正价与B的负价绝对值一定相等;
④电负性A<B;
⑤电离能A>B
其中正确的组合是( )
分析:A元素的阳离子和B元素的阴离子具有相同的电子层结构,则A元素处于B元素的下一周期,A为金属元素,最外层电子数较少,B为非金属元素,最外层电子数相对较多,且A的原子序数大于B.
解答:解:A元素的阳离子和B元素的阴离子具有相同的电子层结构,则A元素处于B元素的下一周期,A为金属元素,最外层电子数较少,B为非金属元素,最外层电子数相对较多,且A的原子序数大于B,
①电子层数相同的阴阳离子,阳离子的原子半径大于阴离子的原子半径,故正确;
②电子层数相同的阴阳离子,离子半径随着原子序数的增大而减小,所以离子半径A<B,故错误;
③A的正价和B的负价的绝对值不一定相等,如Na+和O2-,故错误;
④A是金属,B是非金属,B吸引电子的能力大于A,所以电负性A<B,故正确;
⑤A是金属,B是非金属,所以电离能A<B,故错误;
故选A.
①电子层数相同的阴阳离子,阳离子的原子半径大于阴离子的原子半径,故正确;
②电子层数相同的阴阳离子,离子半径随着原子序数的增大而减小,所以离子半径A<B,故错误;
③A的正价和B的负价的绝对值不一定相等,如Na+和O2-,故错误;
④A是金属,B是非金属,B吸引电子的能力大于A,所以电负性A<B,故正确;
⑤A是金属,B是非金属,所以电离能A<B,故错误;
故选A.
点评:本题考查结构与位置的关系、半径比较等,难度不大,关键是根据离子具有相同的电子层结构推断元素的相对位置,从而比较其它性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
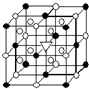 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子