题目内容
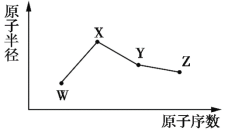
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是原子序数依次增大的五种短周期元素,且
是原子序数依次增大的五种短周期元素,且![]() 是元素周期表中原子半径最小元素,
是元素周期表中原子半径最小元素,![]() 、
、![]() 相邻,
相邻,![]() 元素可以与
元素可以与![]() 、
、![]() 、
、![]() 元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。
元素分别形成甲、乙、丙三种物质,且甲、乙均为10电子化合物,丙为18电子双原子化合物。![]() 元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
元素原子的最外层电子数与核外电子层数相等。已知:甲+丙→丁。下列说法正确的是
A.简单离子半径:![]()
B.![]() 与
与![]() 两种元素共同形成的10电子微粒有3种
两种元素共同形成的10电子微粒有3种
C.![]() 元素在元素周期表中的位置是第二周期第ⅡA族
元素在元素周期表中的位置是第二周期第ⅡA族
D.丁物质由非金属元素组成,只含共价键
【答案】B
【解析】
由题意知,![]() 为
为![]() 元素,丙为
元素,丙为![]() ,10电子化合物可能为
,10电子化合物可能为![]() 、
、![]() 、
、![]() 或
或![]() ,因甲+丙→丁,则甲为
,因甲+丙→丁,则甲为![]() 、丁为
、丁为![]() ,即
,即![]() 为
为![]() 元素、
元素、![]() 为
为![]() 元素,因
元素,因![]() 、
、![]() 相邻,则
相邻,则![]() 为
为![]() 元素,
元素,![]() 元素的最外层电子数与核外电子层数相等,且原子序数大于
元素的最外层电子数与核外电子层数相等,且原子序数大于![]() 元素,则
元素,则![]() 元素处于第三周期,最外层电子数为3,故
元素处于第三周期,最外层电子数为3,故![]() 为
为![]() 元素,再来分析选项即可。
元素,再来分析选项即可。
A.![]() 、
、![]() 、
、![]() 的电子排布相同,核电荷数越大,离子半径越小,故离子半径:
的电子排布相同,核电荷数越大,离子半径越小,故离子半径:![]() ,A项错误;
,A项错误;
B.![]() 与
与![]() 两种元素形成的10电子微粒有
两种元素形成的10电子微粒有![]() 、
、![]() 、
、![]() ,B项正确;
,B项正确;
C.![]() 元素在元素周期表中位于第三周期第ⅢA族,C项错误;
元素在元素周期表中位于第三周期第ⅢA族,C项错误;
D.丁为![]() ,含有离子键、共价键,D项错误;
,含有离子键、共价键,D项错误;
答案选B。

【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
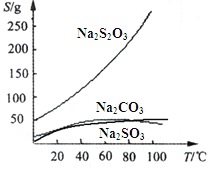
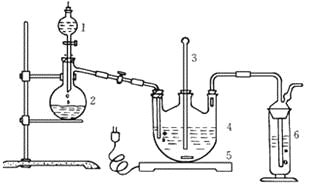
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。
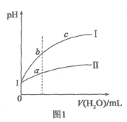
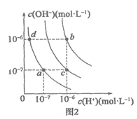
【题目】我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
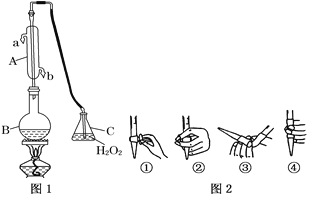
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
A.c(Na+)=c(HSO3-)+2c(SO32-) |
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |