题目内容
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)硝酸厂向大气中排放NO2造成的环境问题是_______________。
(2)为了减少SO2的排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO2,同时又可得到化肥。上述洗涤剂X可以是______(选填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3·H2O
(3)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中形成的化学键是___________(填化学键的类型)。用NaOH溶液吸收少量SO2的离子方程式为____________。
(4)已知:2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=_______。
SO3(g)+NO(g) △H=_______。
(5)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率以[a(NO2)]。部分实验结果如图所示:
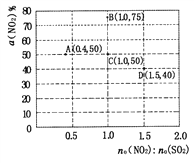
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_________;
②若A点对应实验中,SO2(g)的起始浓度为c0 mol·L-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)= ____mol·L·min-1;
③图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断:Tc_____ Td (填“>”、“=”或“<”)。
【答案】 酸雨、光化学烟雾 bd 共价键 SO2+2OH-=SO32-+H2O -41.8kJ/mol 降低温度 ![]() =
=
【解析】(1)硝酸厂向大气中排放NO2造成的环境问题是酸雨、光化学烟雾等;(2)SO2是酸性氧化物,由于同时又可得到化肥,因此洗涤剂应该是碳酸钾或氨水,答案选bd;(3)发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中生成亚硝酸根、硝酸根和水,形成的化学键是共价键;用NaOH溶液吸收少量SO2反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-=SO32-+H2O;(4)①2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1,盖斯定律计算(②-①)×1/2
得到NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol;
(3)NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol,反应为气体体积不变的放热反应,则
①如果要将图中C点的平衡状态改变为B点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度平衡正向进行;②A.点平衡转化率为50%,n(NO2):n(SO2)=0.4,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=0.4c0mol/L,反应的二氧化氮浓度=0.4c0mol/L×50%=0.2c0mol/L,该时段化学反应速率v(NO2)=0.2cmol/L÷tmin=c0/5tmol/(Lmin);③NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8kJ/mol,反应为放热反应n(NO2):n(SO2)=1,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=c0mol/L,图中C、D两点对应的实验温度分别为Tc和Td,C点二氧化氮转化率为50%,
NO2(g)+SO2(g)SO3(g)+NO(g)
起始浓度(mol/L)c0 c0 0 0
变化浓度(mol/L)0.5c0 0.5c0 0.5c0 0.5c0
平衡浓度(mol/L)0.5c0 0.5c0 0.5c0 0.5c0
平衡常数K=1
D点二氧化氮转化率40%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0 molL-1,NO2起始浓度c(NO2)=1.5c0mol/L,则
NO2(g)+SO2(g)SO3(g)+NO(g)
起始浓度(mol/L) 1.5c0 c0 0 0
变化浓度(mol/L) 0.6c0 0.6c0 0.6c0 0.6c0
平衡浓度(mol/L) 0.9c0 0.4c0 0.6c0 0.6c0
平衡常数K=1
平衡常数相同说明反应温度相同,Tc=Td。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
回答下列问题:
(1)写出对应元素的名称:A__________、B__________、C__________、X__________、Y__________、Z__________
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):__________
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:__________。
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:
__________。
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和">"、"<"或"="表示:)__________并说明理由__________。