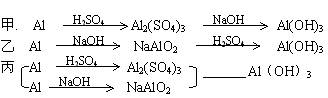题目内容
有200ml氯化镁和氯化铝的混合溶液,其中c(Mg2+) 为0.3mol/L,c(Cl-)为1.5mol/L。要使Mg2+全部转化为沉淀分离出来,至少需加4mol/LNaOH溶液的体积为( )
| A.72ml | B.80ml | C.90ml | D.120ml |
C
试题分析:镁离子和氯离子的物质的量分别是0.06mol和0.3mol,则根据溶液显电中性可知,铝离子的物质的量是(0.3mol-0.06mol×2)÷3=0.06mol。则根据反应的方程式Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O可知,消耗氢氧化钠的物质的量至少是0.06mol×2+0.06mol×4=0.36mol,则氢氧化钠溶液的体积是90ml,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题侧重基础和能力的考查,有利于培养学生灵活运用基础知识解决实际问题的能力。该题的关键是根据电荷守恒得出铝离子的物质的量,然后依据反应的方程式直接列式计算即可。

练习册系列答案
相关题目
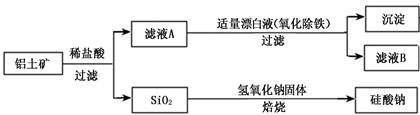
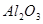 ,含有杂质
,含有杂质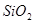 、
、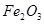 、
、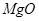 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程: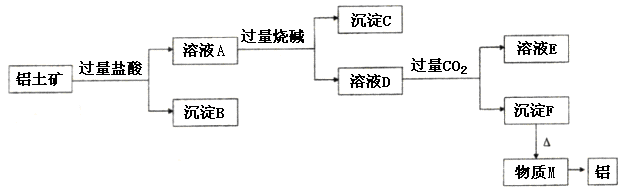
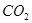 生成沉淀F的离子方程式为_______________________。
生成沉淀F的离子方程式为_______________________。