题目内容
11.Cl2、ClO2、K2FeO4(高铁酸钾)在生产、生活中广泛用于漂白和杀菌消毒.根据所学知识及实验事实回答下列问题: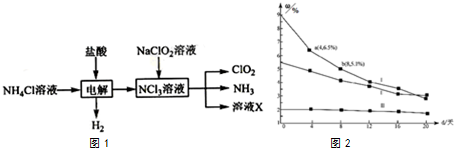
(1)已知高铁酸钾(K2FeO4)具有极强的氧化性,在水溶液中能发生如下反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑.根据此反应可知高铁酸钾在碱性的水溶液中比较稳定.(填“酸性”、“中性”或“碱性”)
高铁酸钾常见制备方法之一是:在碱性条件下,由Fe(NO3)3与NaClO反应生成,完成并配平该反应的离子方程式:□ClO-+□Fe3++□10 OH-═□FeO42-+□Cl-+□5H2O
(2)ClO2的氧化性与Cl2相近,在自来水消毒和果蔬保鲜等方面应用广泛.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
[注:NCl3中N元素为-3价,Cl为+1价]
请仔细分析图1中物质的转化关系,结合氧化还原反应规律完成下面2小题
①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3.
②溶液X中大量存在的两种阴离子是Cl-、OH-.
(3)①用烧碱溶液吸收Cl2可制得漂白液,据此判断漂白液的有效成分为NaClO;
②研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化如图2:分解速率v( I)、v(Ⅱ)的大小关系是v(I)>v(Ⅱ),其原因是在相同条件下,次氯酸钠的浓度越高其分解速率越大.
分析 (1)由4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑可知,碱性溶液在可抑制高铁酸钾与水反应;ClO-+□Fe3+═□FeO42-+□Cl-中,Cl元素的化合价降低,Fe元素的化合价升高,结合电子、电荷及原子守恒分析;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,由转化图可知,电解生成氢气、NCl3;NCl3与NaClO2反应生成ClO2、NH3,则反应物中有水参加反应,生成物中X含NaOH、NaCl;
(3)①用烧碱溶液吸收Cl2可制得漂白液,反应生成NaCl、NaClO,NaClO具有强氧化性;
②由30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化图可知,I的分解速率随其浓度增大而增大.
解答 解:(1)由4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑可知,碱性溶液在可抑制高铁酸钾与水反应,则在碱性溶液中可稳定存在;ClO-+□Fe3+═□FeO42-+□Cl-中,Cl元素的化合价降低,Fe元素的化合价升高,由电子、电荷及原子守恒可知,离子反应为3ClO-+2Fe3++10 OH-=2FeO42-+3Cl-+5H2O,
故答案为:碱性;3;2;10 OH-;2;3;5H2O;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,由转化图可知,电解生成氢气、NCl3;NCl3与NaClO2反应生成ClO2、NH3,则反应物中有水参加反应,生成物中X含NaOH、NaCl,
①电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3;
②X含NaOH、NaCl,溶液X中大量存在的两种阴离子是Cl-、OH-,故答案为:Cl-、OH-;
(3)①用烧碱溶液吸收Cl2可制得漂白液,反应生成NaCl、NaClO,NaClO具有强氧化性,漂白液的有效成分为NaClO,故答案为:NaClO;
②由30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化图可知,在相同条件下,次氯酸钠的浓度越高其分解速率越大,则分解速率v(I)>v(Ⅱ),故答案为:v(I)>v(Ⅱ);在相同条件下,次氯酸钠的浓度越高其分解速率越大.
点评 本题考查物质的性质及氧化还原反应、电解等,注重高频考点的考查,把握习题中的信息及相关反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 反应中每生成1mol N2O,消耗1.5mol CO | |
| B. | B等物质的量的N2O和CO2含有相等的电子数 | |
| C. | N2O只具有氧化性,无还原性 | |
| D. | 反应中每生成1mol N2O,电子转移的物质的量为3mol |
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 | |
| D. | 在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
| 阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
| 阴离子 | NO${\;}_{3}^{-}$ | CO${\;}_{3}^{2-}$ | SiO${\;}_{3}^{2-}$ | SO${\;}_{4}^{2-}$ |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
(1)实验Ⅰ能确定一定不存在的离子是Ag+、Ca2+、Ba2+;
(2)实验Ⅰ中生成气体的离子方程式为CO32-+2H+=H2O+CO2↑;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
| 阴离子 | NO${\;}_{3}^{-}$ | CO${\;}_{3}^{2-}$ | SiO${\;}_{3}^{2-}$ | SO${\;}_{4}^{2-}$ |
| c/mol•L-1 |
| A. | 滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 | |
| B. | 蒸发时,待出现大量固体时停止加热,用余热将其烘干 | |
| C. | 蒸馏时,温度计水银球应位于蒸馏烧瓶支管口处,测量蒸出气体的温度 | |
| D. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| A. | 煤炭 | B. | 石油 | C. | 天然气 | D. | 氢气 |
| A. | 若H2O2分解产生1molO2,转移的电子数为4NA | |
| B. | 2 L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为2NA | |
| C. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA |