题目内容
19.下列说法或表示方法正确的是( )| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由石墨比金刚石稳定可知:C(金刚石,s)═C(石墨,s)△H<0 | |
| D. | 在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
分析 A、反应物的总能量低于生成物的总能量的反应是吸热的,吸热反应在一定条件下可以发生;
B、稀的强酸和强碱发生中和反应生成1mol水放出的热量称为中和热;
C、物质具有的能量越低越稳定;
D、根据热化学方程式系数的意义以及热化学方程式的书写方法来回答.
解答 解:A、反应物的总能量低于生成物的总能量时,该反应是吸热反应,吸热反应在一定的条件下能发生,铵盐和氢氧化钡晶体的反应是吸热的,但是无需条件就发生,故A错误;
B、强酸跟强碱反应放出的热量不一定是中和热,稀的强酸和强碱发生中和反应生成1mol水放出的热量称为中和热,故B错误;
C、由石墨比金刚石稳定,所以石墨的能量低于金刚石,所以:C(金刚石,s)═C(石墨,s)△H<0,故C正确;
D、在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则2molH2完全燃烧生成液态水,放出571.6kJ热量,氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,故D错误.
故选C.
点评 本题涉及中和热的概念、热化学方程式的意义、反应的热效应等反面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
9.化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A. | 家中发生天然气泄漏,不能在室内用电话报警 | |
| B. | 明矾既可用于净水,又可杀菌消毒 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 |
10.某温度下,在体积一定的密闭容器中,适量的氨气和氯气恰好反应,若反应产物只有氮气和NH4Cl固体,则反应前后容器中压强比应接近于( )(8NH3+3Cl2═N2+6NH4Cl )
| A. | 1:11 | B. | 11:1 | C. | 7:11 | D. | 11:7 |
7.下列实验操作或现象解释不正确的是( )
| A. | 进行焰色反应时,必须用稀硫酸洗涤并灼烧铂丝,然后再进行实验 | |
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 读取滴定管内液体体积时,俯视读数导致读数偏小 | |
| D. | 利用一束强光照射明矾水溶液,产生光亮的“通路”,说明明矾一定发生了水解 |
14.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是( )
| A. | K值不变,平衡不可能移动 | |
| B. | 平衡向右移动时,K值一定增大 | |
| C. | K值有变化,平衡一定移动 | |
| D. | 相同条件下,同一个反应,其方程式的计量数增大2倍,K值也增大两倍 |
4.已知热化学方程式:2H2(g)+O2(g)═2H20(g)△H1=-△483.6kJ/mol,则对于热化学方程式:2H20(1)=2H2(g)+02(g)△H2=b,下列说法正确的是( )
| A. | 热化学方程式中化学计量数表示分子个数 | |
| B. | 该反应的△H2=+483.6kJ/mol | |
| C. | △H2<△H1 | |
| D. | △H1<△H2 |
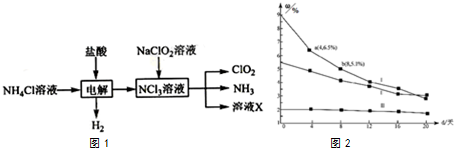
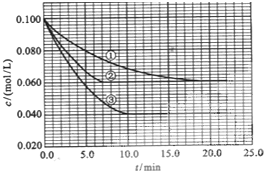 在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.
在溶液中,反应A+2B═C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100kJ•mol-1、c(B)=0.200kJ•mol-1及c(C)=0kJ•mol-1.反应物A的浓度随时间的变化如下图所示.