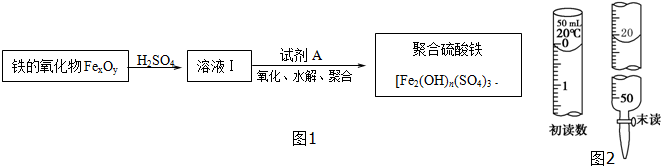
题目内容
2.设NA为阿伏加德罗常数的数值.下列说法错误的是( )| A. | 1mol NH3中含有3NA个N-H键 | |
| B. | 36g C60含分子数为0.05NA | |
| C. | 标准状况下,11.2L CO2中含有2NA个共用电子对 | |
| D. | 18g重水(H2O)中含有10NA个电子 |
分析 A.1个氨气分子中含有3个N-H键;
B.C60相对分子量:720,计算36g的物质的量;
C.1个二氧化碳分子含有4对共用电子对;
D.重水分子中含有10个电子,其摩尔质量为20g/mol;
解答 解:A.1个氨气分子中含有3个N-H键,1mol NH3中含有3NA个N-H键,故A正确;
B.36g C60含分子数=×NA=0.05NA,故B正确;
C.标准状况下,11.2L CO2中含有共用电子对=×4×NA=2NA,故C正确;
D.18g重水的物质的量为:=0.9mol,0.9mol重水中含有9mol电子,含有9NA个电子,故D错误;
故选:D.
点评 本题考查阿伏加德罗常数的综合应用,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.

练习册系列答案
相关题目
12.镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列气可作为冷却气的是( )
| A. | 空气 | B. | 氮气 | C. | 氩气 | D. | 二氧化碳 |
10.短周期元素的简单离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 元素非金属性:Y>Z | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 离子半径:X+<Z- |
17.用一定体积、一定浓度的盐酸跟过量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
| A. | 加少量稀硫酸 | B. | 加热 | C. | 加蒸馏水 | D. | 加少量蓝矾 |
7.下列条件中,锌和硫酸开始反应时放出氢气的速率最大的是( )
| 选项 | 金属 | 酸溶液的浓度和体积 | 温度/℃ |
| A | 2.4 g 锌片 | 3 mol•L -1硫酸50 mL | 40 |
| B | 2.4 g锌粉 | 1 mol•L-1硫酸200 mL | 30 |
| C | 2.4 g锌粉 | 3 mol•L-1硫酸50 mL | 40 |
| D | 5.6 g锌片 | 3 mol•L-1硫酸1 00 mL | 30 |
| A. | A | B. | B | C. | C | D. | D |
14.X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素.下列说法不正确的是( )
| A. | 化合物YZ3极易溶解于水 | |
| B. | Z与M可以形成共价化合物 | |
| C. | 12g14X中含有质子的物质的量为6mol | |
| D. | 由上述四种元素组成的离子化合物受热易分解 |
11.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |

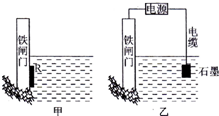 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的