题目内容
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种
阳离子 | H+、Na+、Al3+、Fe3+、NH4+、Mg2+ |
阴离子 | OH-、CO32-、SiO32-、AlO2-、Cl- |
现取适量该溶液,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示:
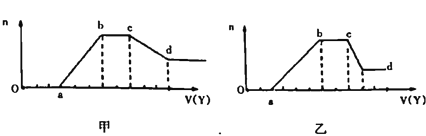
(1)若Y是盐酸,所得到的关系图如甲图所示,则X中一定含有的阴离子是______,X中一定存在的几种阴离子物质的量之比为____(按题干表格中阴离子出现的顺序写比例顺序);ab段发生反应的离子方程式为_________________;cd段发生的反应的离子方程式为______________。
(2)若Y是NaOH溶液,所得到的关系图如乙用所示,X中一定含有的阳离子是_______;ab段发生反应的离子________________;bc段发生反应的离子为________________;cd段发生反应的离子方程式为______________。
【答案】 OH-、CO32-、SiO32-、AlO2- 3:1:1:1 SiO32-+2H+=H2SiO3↓ AlO2-+H++H2O=Al(OH)3↓ Al(OH)3+3H+=AlO2-+2H2O H+、Al3+、NH4+、Mg2+ Al3+、Mg2+ NH4+ Al(OH)3+OH-===AlO2-+2H2O
【解析】(1)无色稀溶液X中不会含有Fe3+,加入盐酸后没有立即产生沉淀,说明含有OH-。沉淀达到最大值后不再发生变化,说明溶液中含有CO32-。然后沉淀开始减少,但没有完全消失,说明形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸中而后者不能,所以溶液中一定存在SiO32-、AlO2-,根据以上分析可知一定不能大量存在H+、Al3+、Mg2+、NH4+,根据电荷守恒可知一定存在Na+。根据图像可知消耗氢氧根需要3体积盐酸,产生沉淀需要3体积盐酸,与碳酸根反应需要2体积盐酸,溶解氢氧化铝需要3体积盐酸,则产生氢氧化铝沉淀需要1体积盐酸,因此产生硅酸沉淀需要1体积盐酸,所以OH-、AlO2-、SiO32-、CO32-物质的量之比为3:1:1:1;ab段发生反应的离子方程式为SiO32-+2H+=H2SiO3↓、AlO2-+H++H2O=Al(OH)3↓;cd段发生的反应的离子方程式为Al(OH)3+3H+=AlO2-+2H2O。(2)无色稀溶液X中不会含有Fe3+,若Y是NaOH溶液,加入氢氧化钠后不立即产生沉淀,说明含有H+,所以不能大量存在氢氧根。沉淀达到最大值后不再发生变化,说明还含有NH4+。继续加入氢氧化钠沉淀开始减少,但不能完全溶解,说明沉淀是氢氧化铝和氢氧化镁,即一定含有Al3+、Mg2+,所以CO32-、SiO32-、AlO2-一定不能存在,根据溶液显电中性可知Cl-一定存在。根据以上分析可知ab段发生反应的离子为Al3+、Mg2+;bc段发生反应的离子为NH4+;cd段发生反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4 , 其过程如下: I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.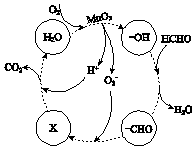
【资料】部分阳离子形成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
(1)I中向软锰矿浆中通入SO2生成MnSO4 , 该反应的化学方程式是 .
(2)II 中加入MnO2的主要目的是;调溶液 pH=4.7,生成的沉淀主要含有 和少量CaSO4 .
(3)III中加入阳离子吸附剂,主要除去的离子是 .
(4)用惰性电极电解MnSO4溶液,可以制得高活性MnO2 . ①电解MnSO4溶液的离子方程式是
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是 , 总反应的化学方程式是 .