题目内容
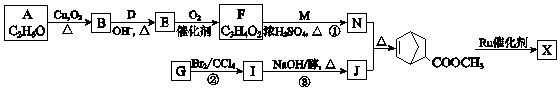
【题目】某研究性实验小组欲验证浓硝酸在与Cu、Ag 合金的反应过程中除生成NO2气体外,还会有少量NO生成。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装器。

请回答下列问题
(1)写出A中银与HNO3反应时所有可能的离子方程式_____________________。
(2)实验开始时,打开分液漏斗前要先打开活塞______( 填“K1”或“K2”),其目的是___________。
(3)装置中B瓶选用的试剂______________。
a.H2O b.浓硫酸 c.NaOH 熔液
(4)装置E中长颈漏斗的作用____________。
(5)反应停止后,欲想证明有NO生成,需要怎样操作:__________,当出现何种现象说明有NO生成____________。
【答案】 Ag+2H++NO3-=Ag++NO2↑+H2O 3Ag+4H++NO3-=3Ag++NO↑+2H2O K1 把装置中空气赶走,防止NO被氧化 b 防止倒吸 打开D中的活塞K2并通入O2 D中无色气体变成红棕色
【解析】(1)银和浓硝酸反应生成二氧化氮、硝酸银和水,随着反应的进行,硝酸浓度变稀,银和稀硝酸反应生成一氧化氮气体,硝酸银和水,反应的可能化学方程式为Ag+2H++NO3-=Ag++NO2↑+H2O、3Ag+4H++NO3-=3Ag++NO↑+2H2O;(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;因此实验开始时,打开分液漏斗前要先打开活塞K1,其目的是把装置中空气赶走,防止NO被氧化;(3)B装置是吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,所用试剂是浓硫酸,答案选b;(4)由于氢氧化钠吸收尾气时可能会发生倒吸现象,所以装置E中长颈漏斗的作用是防止倒吸;(5)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色二氧化氮气体。

【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种
阳离子 | H+、Na+、Al3+、Fe3+、NH4+、Mg2+ |
阴离子 | OH-、CO32-、SiO32-、AlO2-、Cl- |
现取适量该溶液,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示:
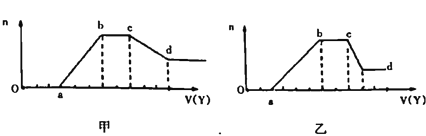
(1)若Y是盐酸,所得到的关系图如甲图所示,则X中一定含有的阴离子是______,X中一定存在的几种阴离子物质的量之比为____(按题干表格中阴离子出现的顺序写比例顺序);ab段发生反应的离子方程式为_________________;cd段发生的反应的离子方程式为______________。
(2)若Y是NaOH溶液,所得到的关系图如乙用所示,X中一定含有的阳离子是_______;ab段发生反应的离子________________;bc段发生反应的离子为________________;cd段发生反应的离子方程式为______________。