题目内容
【题目】氮化硅(Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域中有重要用途。
Ⅰ.工业上有多种方法来制备氮化硅,下面是几种常见的方法:
(1)方法一 直接氮化法:在1300~1400 ℃时,高纯粉状硅与纯氮气化合,其反应方程式为3Si+2N2![]() Si3N4
Si3N4
(2)方法二 可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜,其反应方程式为___________________。
(3)方法三 化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl,与方法一相比,用此法制得的氮化硅纯度较高,其原因是___________________。
(4)方法四 Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体__________________(填分子式);然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为_________________。
Ⅱ.工业上制取高纯硅和四氯化硅的生产流程如下:
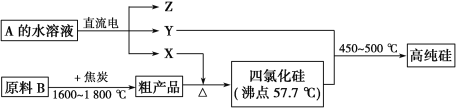
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
(1)写出焦炭与原料B中的主要成分反应的化学方程式:__________________
(2)上述生产流程中电解A的水溶液时,以Cu为阳极电解A的水溶液电解反应方程式为 。
【答案】
Ⅰ.(2)方法二:3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
(3)方法三:方法一所得到的产品中混有单质硅(或方法二除产品是固体外,其他物质均为气体)
(4)方法四:HCl、NH3
Ⅱ.(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)Cu+2H2O=H2↑+Cu(OH)2
【解析】
试题分析:I、(2)方法二 可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜,其反应方程式为3SiH4+4NH3![]() Si3N4+12H2[,故答案为:3SiH4+4NH3
Si3N4+12H2[,故答案为:3SiH4+4NH3![]() Si3N4+12H2[;
Si3N4+12H2[;
方法三:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体,故方法二得到氮化硅纯度较高;故答案为:方法一所得到的产品中混有单质硅,而方法二除产品是固体,其他物质均为气体;
方法四:依据化学反应中原子个数守恒可知四氯化硅与氨气反应:3SiCl4+4NH3=Si3N4+12HCl,依据化学反应中原子个数守恒可知3Si(NH2)4![]() Si3N4+8NH3 ,故答案为:HCl;NH3.
Si3N4+8NH3 ,故答案为:HCl;NH3.
Ⅱ、原料B与碳得到粗产品与X反应,生成SiCl4,则X为氯气,原料B与碳得到粗产品为Si,故B为SiO2.Y与氯气在光照或点燃条件下可反应,且与SiCl4反应得到高纯度Si,则Y为氢气.Z的焰色呈黄色,含有Na元素,电解A得到氢气、氯气与Z,则Z为NaOH、A为NaCl。
(1)焦炭具有还原性,与SiO2发生氧化还原反应,生成Si与CO,反应方程式为:SiO2+2C![]() Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)Cu为阳极电解NaCl的水溶液开始一段时间,阳极Cu放电生成铜离子,阳极电极反应式为:Cu-2e-=Cu2+,阴极水放电生成氢气与氢氧根离子,阴极电极反应式为:2H2O+2e-=H2↑+2OH-,电解反应方程式为Cu+2H2O=H2↑+Cu(OH)2,故答案为:Cu+2H2O=H2↑+Cu(OH)2。