题目内容
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
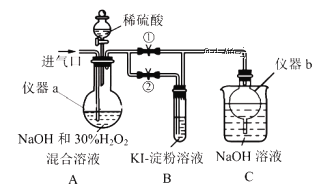
Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
(1)仪器a的名称为______________,仪器b的作用是______________。
(2)装置A中生成NaClO2的离子方程式为____________________________。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、_____、_____、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________。
(5)B中现象为_________________ 。产生该现象的离子方程式为___________________。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,__________________________________。
【答案】烧瓶(圆底烧瓶) 防止倒吸 2ClO2+2OH-+H2O2=2ClO2-+H2O+O2↑ 降温结晶 过滤 NaClO2与H2SO4反应生成的Cl-对反应起催化作用 溶液变蓝色 2ClO2+10I-+8H+=2Cl-+5I2+4H2O 从进气口通入一段时间的空气
【解析】
( 1 )根据仪器a的特点,仪器a为圆底烧瓶,仪器b为干燥管,因此仪器b的作用是防止倒吸;
(2 )根据实验步骤,装置A中加入NaOH、H2O2和ClO2 ,产物是NaClO2 ,Cl的化合价降低,即ClO2作氧化剂,H2O2作还原剂, H2O2的氧化产物是O2,因此有ClO2 + H2O2+OH-→ClO2 - +O2↑ + H2O,根据化合价升降法进行配平,得出仪器A中发生离子反应方程式为2ClO2+ 2OH- +H2O2=2ClO2- +H2O+O2↑;
(3)蒸发浓缩、降温结晶,得到NaClO2固体,然后过滤、洗涤、干燥;
(4) NaClO2在酸性条件下能生成NaCl和ClO2,发生的反应是5NaClO2 + 2H2SO4=NaCl+ 4ClO2↑+ 2H2O + 2Na2SO4 ,开始时A中反应缓慢,稍后产生气体的速率急剧加快的原因可能是NaClO2与H2SO4反应生成的Cl-对反应起催化作用;
( 5) ClO2的性质与氯相似,即ClO2的氧化性强于I2,ClO2把I -氧化成I2,淀粉遇碘单质变蓝,即B中现象是溶液变蓝色;
(6) 为了让有毒气体完全被吸收,在进气口通入一段时间的空气。

 名校课堂系列答案
名校课堂系列答案