题目内容
A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同.A与C、B与D分别分别为同主族,B与C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子,请回答下列问题:
(1)E元素单质的电子式为______,D元素简单离子的结构示意图______.
(2)由A、B、C三种元素形成的化合物与E元素单质反应的离子方程式______.
(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,该反应的化学方程式为______.
(4)C、D二种元素形成的一种盐,在常温下pH______7(填“>”“<”或“=”),原因______(用离子方程式表示)
(5)由A的单质与空气形成的燃料电池中,用KOH溶液作电解质溶液,则负极反应式是______.
(1)E元素单质的电子式为______,D元素简单离子的结构示意图______.
(2)由A、B、C三种元素形成的化合物与E元素单质反应的离子方程式______.
(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,该反应的化学方程式为______.
(4)C、D二种元素形成的一种盐,在常温下pH______7(填“>”“<”或“=”),原因______(用离子方程式表示)
(5)由A的单质与空气形成的燃料电池中,用KOH溶液作电解质溶液,则负极反应式是______.
A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C、B与D分别分别为同主族,则B处于第二周期、D处于第三周期、C处于第三周期,故C为钠元素;B与C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,所以B为氧元素,D为硫元素.
(1)E元素单质为氯气,电子式为 ;D元素简单离子是S2-,核外电子数为18,有3个电子层,最外层电子数为8,结构示意图为
;D元素简单离子是S2-,核外电子数为18,有3个电子层,最外层电子数为8,结构示意图为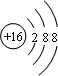 .
.
故答案为: ;
; .
.
(2)由A、B、C三种元素形成的化合物是NaOH,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,则为H2SO3与H2O2反应生成硫酸与水,该反应的化学方程式为H2SO3+H2O2=H2SO4+H2O.
故答案为:H2SO3+H2O2=H2SO4+H2O.
(4)C、D二种元素形成的一种盐为Na2S,Na2S是强碱弱酸盐,S2-水解S2-+H2O?HS-+OH-,溶液呈碱性,常温下pH>7(,故答案为:>;S2-+H2O?HS-+OH-.
(5)由氢气与空气形成的燃料电池中,用KOH溶液作电解质溶液,原电池负极反应氧化反应,氢气在负极放电,在碱性条件下生成水,电极反应式为H2-2e-+2OH-=2H2O.
故答案为:H2-2e-+2OH-=2H2O.
(1)E元素单质为氯气,电子式为
 ;D元素简单离子是S2-,核外电子数为18,有3个电子层,最外层电子数为8,结构示意图为
;D元素简单离子是S2-,核外电子数为18,有3个电子层,最外层电子数为8,结构示意图为 .
.故答案为:
 ;
; .
.(2)由A、B、C三种元素形成的化合物是NaOH,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
(3)A、B、D三种元素形成的一种化合物与A、B形成的一种化合物能发生氧化还原反应,则为H2SO3与H2O2反应生成硫酸与水,该反应的化学方程式为H2SO3+H2O2=H2SO4+H2O.
故答案为:H2SO3+H2O2=H2SO4+H2O.
(4)C、D二种元素形成的一种盐为Na2S,Na2S是强碱弱酸盐,S2-水解S2-+H2O?HS-+OH-,溶液呈碱性,常温下pH>7(,故答案为:>;S2-+H2O?HS-+OH-.
(5)由氢气与空气形成的燃料电池中,用KOH溶液作电解质溶液,原电池负极反应氧化反应,氢气在负极放电,在碱性条件下生成水,电极反应式为H2-2e-+2OH-=2H2O.
故答案为:H2-2e-+2OH-=2H2O.

练习册系列答案
相关题目