题目内容
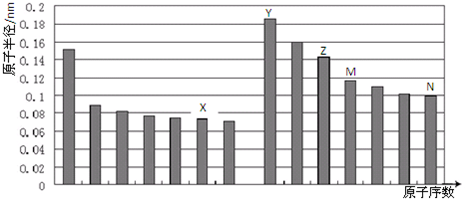
不同元素的原子在分子内吸引电子的能力大小可用x表示,x越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的x值.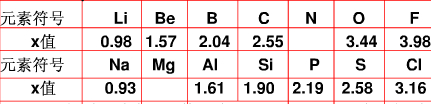
(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:______、N:______.
(2)短周期元素x值的变化特点体现了元素性质的______变化规律.
(3)某有机物分子中含有S-N键,你认为电子对偏向______原子(填元素符号).
(4)经验规律告诉我们,当成键的两原子相应元素的x差值△x大于l.7时一般形成离子键,△x小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是______.设计实验验证你的预测______.

(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:______、N:______.
(2)短周期元素x值的变化特点体现了元素性质的______变化规律.
(3)某有机物分子中含有S-N键,你认为电子对偏向______原子(填元素符号).
(4)经验规律告诉我们,当成键的两原子相应元素的x差值△x大于l.7时一般形成离子键,△x小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是______.设计实验验证你的预测______.
(1)根据电负性的递变规律:同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,可知,在同周期中电负性Na<Mg<Al,同主族Be>Mg>Ca,最小范围应为0.93~1.57;同理,在同周期中电负性C<N<O,同主族N>P,
最小范围应为2.55~3.44;故答案为:0.93~1.57;2.55~3.44.
(2)因每隔一定数目的原子,元素的电负性逐渐增大,这种变化称为周期性,故答案为:周期性.
(3)因N的电负性大于S的电负性,所以N吸引电子的能力强,故答案为:N.
(4)因同主族,电负性逐渐减小,故Br的电负性小于3.16,所以AlBr3中Al与Br的电负性差值<1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlBr3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电.故答案为:共价键;测定熔融状态下是否导电,若不导电则为共价键.
最小范围应为2.55~3.44;故答案为:0.93~1.57;2.55~3.44.
(2)因每隔一定数目的原子,元素的电负性逐渐增大,这种变化称为周期性,故答案为:周期性.
(3)因N的电负性大于S的电负性,所以N吸引电子的能力强,故答案为:N.
(4)因同主族,电负性逐渐减小,故Br的电负性小于3.16,所以AlBr3中Al与Br的电负性差值<1.55,根据信息,电负性差值若小于1.7,则形成共价键,所以AlBr3为共价化合物.离子化合物在熔融状态下以离子形式存在,可以导电,但共价化合物不能导电.故答案为:共价键;测定熔融状态下是否导电,若不导电则为共价键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目