题目内容
【题目】某含C、H、O三种元素的未知物M的相对分子质量小于100,经燃烧分析实验测定该未知物碳的质量分数为40%,氢的质量分数为6.7%。由此所得结论正确的是
A. M的分子式为CH2O B. M的实验式为CH30
C. M不可能是2-羟基丙酸 D. M可能是饱和一元羧酸
【答案】D
【解析】分析:碳的质量分数是40%,氢的质量分数是6.7%,则氧元素质量分数是1-40%-6.7%=53.3%,则该物质中碳、氢、氧原子个数之比=![]() ,即最简式为CH2O,据此解答。
,即最简式为CH2O,据此解答。
详解:A. M最简式为CH2O,M的相对分子质量小于100,因此M的分子式可能是CH2O、C2H4O2或C3H6O3,A错误;
B. 根据以上分析可知M的实验式为CH20,B错误;
C. M的分子式如果是C3H6O3,则可能是2-羟基丙酸,C错误;
D. M的分子式如果是C2H4O2,M可能是饱和一元羧酸,即乙酸,D正确。答案选D。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
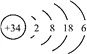
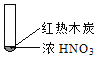
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应