题目内容
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用.
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮.二者在反应过程中放出大量能量,同时生成无毒、无污染的气体.已知室温下,0.1mol燃料完全燃烧释放出的能量为255kJ,请写出该反应的热化学方程式__ ;
(2)298K时,在2L的密闭容器中,发生可逆反应2NO2(g) N2O4(g)△H=-a kJ•mol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.
N2O4(g)△H=-a kJ•mol-1 (a>0).N2O4的物质的量浓度随时间变化如图1.达平衡时,N2O4的浓度为NO2的2倍,回答下列问题.

① 298k时,该反应的平衡常数为___________;②若反应在398K进行,某时刻测得n(NO2)=0.6mol,n(N2O4)=1.2mol,则此时V(正)_ _V(逆)(填“>”、“<”或“=”).

③在温度为T1、T 2时,平衡体系中NO2的体积分数随压强变化曲线如图3所示。下列说法正确的是___________
2时,平衡体系中NO2的体积分数随压强变化曲线如图3所示。下列说法正确的是___________
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B=C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示.试分析图中a、b、c、d、e五个点,①水的电离程度最大的是___________,②其溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值的是___________。
练习册系列答案
相关题目


 3Mg+Al2O3
3Mg+Al2O3 xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是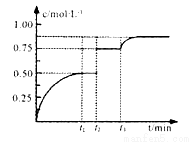
 时刻改变的条件是移去少量物质D
时刻改变的条件是移去少量物质D