题目内容
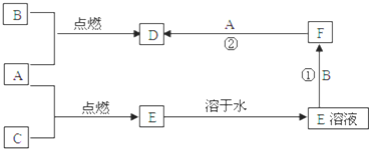
【题目】短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17gL-1,常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系
;0.1molL-1Z的水溶液pH=13。X2、Y和Z之间有如下转化关系![]() 其他无关物质已略去
其他无关物质已略去![]() :
:
(1)写出单质X2与Z反应的离子方程式:______________________________________。
(2)已知16g单质Y完全燃烧放出148kJ热量。写出热化学方程式:________________。
(3)已知C能与较浓盐酸反应生成能使品红溶液褪色的气体
①D的化学式是:_________;D的水溶液pH>7,原因是![]() 用离子方程式表示
用离子方程式表示![]() :_____________。
:_____________。
②0.1molL-1的D溶液中各离子浓度由大到小的顺序为_______________________。
③将20mL0.5molL-1溶液逐滴加入到20mL0.2molL-1 KMnO4溶液![]() 硫酸酸化
硫酸酸化![]() 中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
中,溶液恰好褪为无色。写出反应的离子方程式:_________________________________。
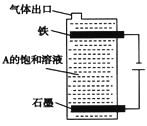
(4)①石墨和铁做电极,用隔膜电解槽电解A的溶液,阳极可产生X2。则铁做_________极。
②按下图电解A的饱和溶液,写出该电解池中较长时间内发生反应的总反应方程式: ________。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是_________。
【答案】Cl2+2OH-= Cl-+ClO-+H2O S(s)+O2 (g)=SO2 (g)H=-296kJ/mol K2S H2O + S2- HS-+OH- c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+) 5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O 阴 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 溶液先变红后褪色
2NaOH+H2↑+Cl2↑ 溶液先变红后褪色
【解析】
标准状况下X2的密度为3.17gL-1,则相对分子质量为3.17×22.4=71,应为Cl2,Y为浅黄色固体单质,应为S,Z是一种化合物,焰色反应呈浅紫色![]() 透过钴玻璃
透过钴玻璃![]() ,应含有K元素,且常温下,0.1molL-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S。
,应含有K元素,且常温下,0.1molL-1Z的水溶液pH=13,说明Z为一元强碱,则Z为KOH,S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S。
(1)常温下Cl2与KOH反应的离子方程式为Cl2+2OH-= Cl-+ClO-+H2O;
(2)n(S)=![]() =0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,热化学方程式为S(s)+O2 (g)=SO2 (g)H=-296kJ/mol;
=0.5mol,完全燃烧生成气态产物时放出148kJ热量,则1molS完全燃烧放出296kJ的热量,热化学方程式为S(s)+O2 (g)=SO2 (g)H=-296kJ/mol;
(3)S和KOH反应生成K2SO3和K2S,已知C能与硫酸反应生成能使品红溶液褪色的气体,应为SO2,则C为K2SO3,D为K2S,
①D为K2S,为强碱弱酸盐,发生H2O + S2- HS-+OH-,HS-+ H2O H2S+OH-,则溶液呈碱性,一步水解程度大于第二步水解程度,则水溶液中离子浓度由大到小顺序为c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
②n(SO32-)=0.02×0.5=0.01mol,n(MnO4-)=0.02×0.2=0.004mol,物质的量之比为5:2,
反应的离子方程式为5SO32-+2MnO4-+6H+=5SO42-+2Mn2++3H2O;
(4)①工业上常以石墨和铁分别做电极,用隔膜法电解某盐溶液来生产Cl2和NaOH,铁应作电解池的阴极;
②用电解饱和NaCl溶液的方法制取,反应的总反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,电解后生成的NaOH与Cl2反应生成NaClO,故滴入酚酞中,溶液先变红后褪色。
2NaOH+H2↑+Cl2↑,电解后生成的NaOH与Cl2反应生成NaClO,故滴入酚酞中,溶液先变红后褪色。