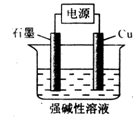
题目内容
用惰性电极电解500 mL CuSO4溶液,电解一段时间后,发现阴极增重0.064 g(假设电解时该电极无H2析出,且不考虑水解和溶液体积变化),此时溶液中c(H+)约为
| A.4×10-3 mol·L-1 | B.2×10-3 mol·L-1 | C.1×10-4 mol·L-1 | D.1×10-7 mol·L-1 |
A
总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4,
2Cu+O2↑+2H2SO4,
电极反应:阴极 2Cu2+十4e—=2Cu 阳极 4OH——4e—=2H2O十O2↑;阴极析出铜0.001mol,阳极产生0.001mol H2SO4,0.002mol H+,c(H+)=4×10-3 mol·L-1。
 2Cu+O2↑+2H2SO4,
2Cu+O2↑+2H2SO4, 电极反应:阴极 2Cu2+十4e—=2Cu 阳极 4OH——4e—=2H2O十O2↑;阴极析出铜0.001mol,阳极产生0.001mol H2SO4,0.002mol H+,c(H+)=4×10-3 mol·L-1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。
HC1+HC1O。常温下在一个容积为50mL的针筒(如图所示,活塞可自由滑动,针筒上有刻度)里吸入40mLCl2和l0mL H2O。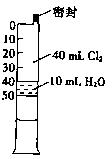
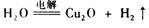 。下列说法错误的是
。下列说法错误的是