题目内容
【题目】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ ![]() O2(g)
O2(g)![]() CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
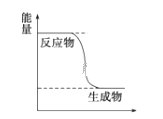
A.CH3OH转变成H2的过程是一个吸收能量的过程
B.H2的生成速率与CH3OH的消耗速率之比为1:2
C.化学变化不仅有新物质生成,同时也一定有能量变化
D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
A.电池放电时通入空气的电极为负极
B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O
C.电池放电时,电解质溶液的碱性逐渐减弱
D.电池放电时每消耗6.4gCH3OH转移1.2mol电子
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ .
【答案】 CD 0.8 64% CD CH3OH+H2O-6e-=CO2↑+6H+
【解析】化学反应不仅有新物质生成,还一定伴随着能量变化;根据反应物总能量与生成物总能量大小可确定是吸热反应还是放热反应;化学反应快慢可用除固体和纯液体物质以外的物质来表示反应速率,不论是正反应速率还是逆反应速率,且速率数值之比等于对应的计量系数之比;当正反应速率等于逆反应速率时,反应达到平衡状态,即达到了最大限度;平衡时某物质的转化量与起始量之比即为转化率;根据氧化还原反应中化合价变化情况,可确定电子转移的方向和数目,失去电子的物质作电池的负极反应物,得到电子的物质作电池的正极反应物,电解质溶液中的阴离子向负极移动,阳离子向正极移动,综合分析即可解答原电池问题。
(1)A、由图象可知,反应物总能量大于生成物总能量,所以这是一个放热反应,故A不正确;B、根据反应速率之比等于计量系数之比,H2的生成速率与CH3OH的消耗速率之比为2:1,则B不正确;C、化学反应不仅有新物质生成,同时还一定伴随着能量变化,即C正确;D、当有1molH-O键断裂表示正反应速率,同时有2molC=O键断裂表示逆反应速率,且二者意义相等,说明反应已达平衡状态,即反应达到最大限度,故D正确。本题答案为CD。
(2)根据已知数据,4min达到平衡时△c(O2)=1mol/L-0.2mol/L=0.8mol/L,则△c(H2)= 4×0.8mol/L=3.2mol/L,v(H2)=![]() =0.8mol/(L·min);△c(CH3OH)=2×0.8mol/L=1.6 mol/L,则CH3OH的转化率为
=0.8mol/(L·min);△c(CH3OH)=2×0.8mol/L=1.6 mol/L,则CH3OH的转化率为![]() ×100%=64%。
×100%=64%。
(3) A、根据甲醇燃烧过程中的电子转移情况可知,通甲醇的一极为负极,通空气的一极为正极,故A不正确;B、在碱性溶液中的负极反应式为CH3OH+8OH-6e-=CO32-↑+6H2O,则B不正确;C、在放电过程中,OH-逐渐与甲醇生成的CO2反应生成CO32-导致碱性减弱,即C正确;D、电池放电时每消耗6.4gCH3OH,即0.2mol,则转移电子6×0.2mol=1.2mol,所以D正确。本题答案为CD。
(4)甲醇燃料电池在酸性条件下负极的反应式为CH3OH+H2O-6e-=CO2↑+6H+。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
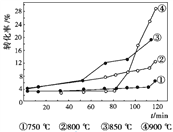
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
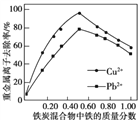
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。